Die Polyene, die wir im vorherigen Abschnitt kennengelernt haben, gehören zu den einfachsten organischen Farbstoffen. Je mehr konjugierte C=C-Doppelbindungen ein Polyen hat, desto energieärmer und damit auch langwelliger kann das Licht sein, dass einen HOMO->LUMO-Übergang verursacht.
Die meisten organischen Farbstoffe sind jedoch komplizierter aufgebaut als die Polyene, sie besitzen - oft aromatische - Ringsysteme und enthalten funktionelle Gruppen, welche beide die Absorption von Licht stark beeinflussen.
In meinem Lieblings-Lehrbuch der Organischen Chemie, dem guten alten Morrison Boyd, wird als anschauliches Beispiel die Verbindung Benzophenon mit der Verbindung Benzil verglichen.

Die aromatischen Verbindungen Benzophenon und Benzil
Alle C-Atome und auch die O-Atome dieser beiden Verbindungen sind sp2-hybridisiert, besitzen also p-Orbitale, die sich gegenseitig überlappen können, so dass sich die pi-Elektronen im gesamten Molekül delokalisiert frei bewegen können. Wieso bewirkt jetzt die zusätzliche Carbonylgruppe des Benzils die Absorption von sichtbarem Blaulicht? Schauen wir uns die C=O-Gruppe einmal näher an.
Die C=O-Gruppe
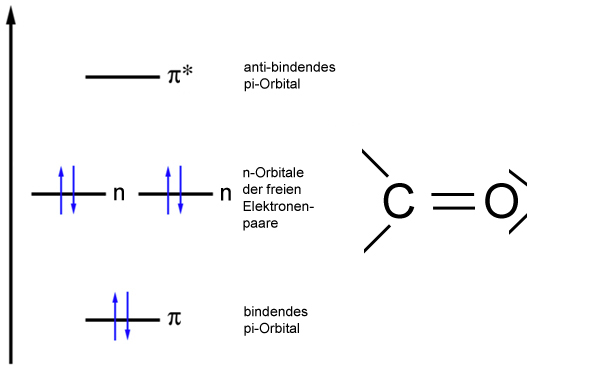
Energiediagramm der MOs der Carbonylgruppe
Die Carbonylgruppe besteht bekanntlich aus einem C-Atom und einem O-Atom, beide sind durch eine Doppelbindung miteinander verbunden. Das O-Atom besitzt außerdem zwei freie Elektronenpaare. Nach dem Orbitalmodell sind beide Atome sp2-hybridisiert, stellen also je ein einfach besetztes pz-Orbital zur Verfügung, so dass neben der sigma-Bindung auch eine pi-Bindung zwischen dem O-Atom und dem C-Atom entstehen kann.
Nach der MO-Theorie kann man der pi-Bindung zwei Molekülorbitale zuordnen, ein bindendes und ein anti-bindendes pi-Orbital. Bei der C=O-Doppelbindung müssen wir auch die beiden freien Elektronenpaare des O-Atoms berücksichtigen. Nach der MO-Theorie bilden diese beiden freien Elektronenpaare sogenannte n-Orbitale(nicht-bindende Orbitale). Da die freien Elektronenpaare keinen Beitrag zu einer chemischen Bindung leisten, liegt das Energieniveau dieser n-Orbitale genau in der Mitte zwischen den bindenden und anti-bindenden pi-Orbitalen. Allerdings sind die beiden nicht-bindenden n-Orbitale mit je zwei Elektronen besetzt.
Das folgende Bild zeigt nun, wieso die Carbonylgruppe die Farbe einer organischen Verbindung beeinflussen kann:

Die Molekülorbitale der C=C-Doppelbindung und der Carbonylgruppe im Vergleich
Beim Ethen-Molekül ist der HOMO-LUMO-Abstand recht groß, nur durch UV-Licht kann ein Elektron auf das LUMO-Niveau befördert werden. Bei der C=O-Gruppe dagegen ist der HOMO-LUMO-Abstand deutlich kleiner, wegen der beiden nicht-bindenden Molekülorbitale, die mit den freien Elektronenpaaren besetzt sind.
Ein zweites, nicht ganz so spektakuläres Beispiel für den Einfluss der Carbonylgruppe auf die Absorption von Licht ist der Vergleich von Butadien und 3-Buten-2-on:
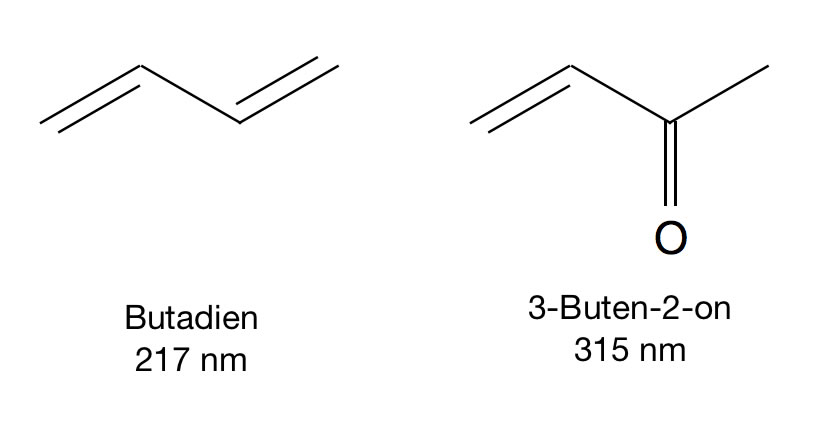
Vergleich der beiden Verbindungen Butadien und 3-Buten-2-on
Das 3-Buten-2-on ist zwar nicht farbig, dennoch sorgt die Carbonylgruppe dafür, dass deutlich langwelligeres Licht absorbiert wird als beim Butadien (315 nm vs. 217 nm).
Auxochrome, Antiauxochrome und bathochromer Effekt
Auxochrome
Auxochrome sind funktionelle Gruppen, welche die Lichtabsorption eines Farbstoff-Moleküls oder eines Chromophors (einer färbenden Gruppe) zum längerwelligen Bereich des Spektrums verschieben (Wikipedia). In der Regel hat eine auxochrome Gruppe gleichzeitig einen +I-Effekt, schiebt also Elektronen in den Chromophor hinein und erhöht dort die Elektronendichte. Auxochrome sind also Elektronen-Donatoren!
Diese Erhöhung der Elektronendichte sorgt dann für eine stärkere Delokalisierung der pi-Elektronen, und das wiederum führt dazu, dass sich diese Elektronen leichter anregen lassen, also durch längerwelliges Licht. Bereits Gruppen, die lediglich einen +I-Effekt bewirken, haben einen auxochromen Effekt. Verstärken lässt sich dieser Effekt, wenn die auxochrome Gruppe zusätzlich einen +M-Effekt hat, wenn sich also die Anzahl der Grenzstrukturen des Farbstoff-Moleküls durch die auxochrome Gruppe erhöht.
Beispiele für Auxochrome sind die OH-Gruppe, die NH2-Gruppe, ein negativ geladenes O-Atom oder eine Phenyl-Gruppe (also ein Benzolring).
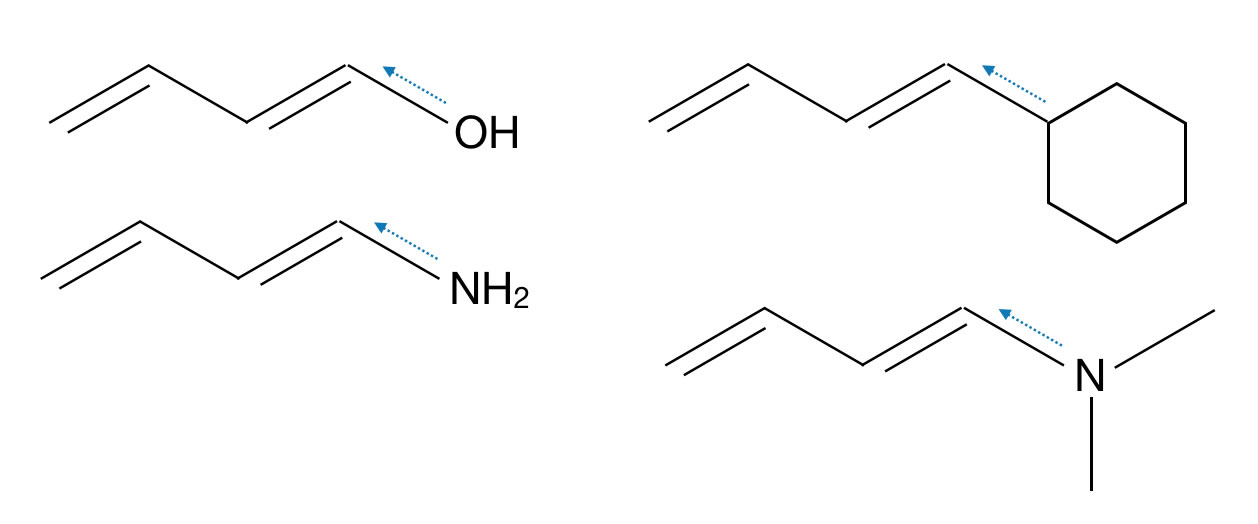
Vier Beispiele für auxochrome Gruppen
Antiauxochrome
Wenn Auxochrome Elektronen-Donatoren sind, die die Elektronendichte im delokalisierten System erhöhen, dann werden Anti-Auxochrome wohl Elektronen-Akzeptoren sein, welche die Elektronendichte erniedrigen. Durch den Einfluss von Antiauxochromen sollte die Farbigkeit einer organischen Verbindung also eigentlich abnehmen, da kürzerwelliges Licht für einen HOMO -> LUMO-Übergang benötigt wird. Gute Beispiele für Antiauxochrome sind die Nitrogruppe und die Carbonylgruppe.
Bathochromer und hypsochromer Effekt
Unter einem bathochromen Effekt versteht man allgemein eine Farbvertiefung, also eine Verschiebung des Absorptionsmaximums eines Farbstoffes in den längerwelligen Bereich. Auxochrome wie -OH oder -NH2 bewirken einen solchen bathochromen Effekt, Antiauxochrome bewirken an sich das Gegenteil, also eine Blauverschiebung, was dann als hypsochromer Effekt bezeichnet wird.
Ein berühmtes Beispiel sind die Farbstoffe Indigo und Purpur. Indigo ist ein bekannter blauer Farbstoffe, der vor allem durch das Färben von Jeans bekannt geworden ist. Purpur hat fast die gleiche Strukturformel wie Indigo, besitzt aber zwei zusätzliche Brom-Atome. Diese beiden Brom-Atome bewirken, dass die Verbindung kürzerwelliges Licht absorbiert als Indigo. Einen solchen farbabschwächenden Effekt bezeichnet man auch als hypsochromen Effekt.
Allerdings können Antiauxochrome den Effekt von Auxochromen eigenartigerweise verstärken, nämlich dann, wenn ein Auxochrom von einer Seite Elektronen in den Chromophor "hineinschiebt" (+I-, +M-Effekte), während gleichzeitig ein Antiauxochrom von der anderen Seite Elektronen aus dem Chromophor "herauszieht (-I-, -M-Effekte). Hier ein bekanntes Beispiel aus einem bekannten Schulbuch (Schroedel, Chemie heute):
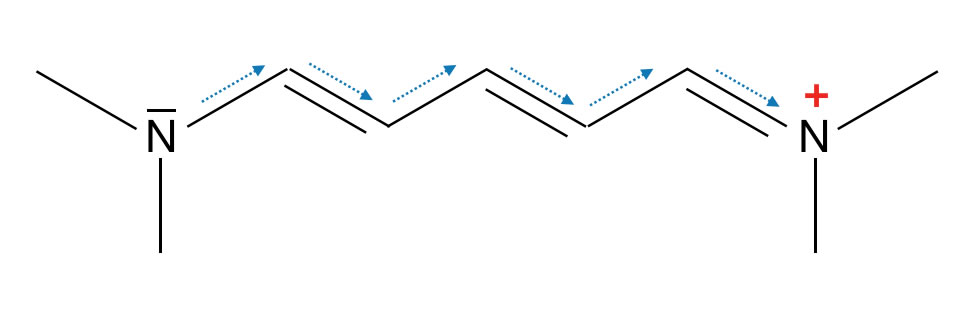
Push-pull-Effekt bei einem Cyanin
Wie man auf dieser Abbildung gut sehen kann, schiebt die linke $N(CH_{3})_{2}-$ Gruppe Elektronen in das pi-Elektronensystem hinein ("push"), während die rechte $N(CH_{3})_{2}^{+}-$ Gruppe Elektronen herauszieht ("pull). Dieser "push-pull-Effekt" führt dazu, dass der Farbstoff sichtbares Licht absorbiert, obwohl er nur drei Doppelbindungen besitzt.
Seitenanfang -
Weiter mit dem Tomatensaft-Versuch…