Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie
- Den Aufbau der C=C-Doppelbindung nach dem Orbitalmodell genau beschreiben können,
- den Unterschied zwischen sigma-Bindung und pi-Bindung kennen,
- das bindende und das anti-bindende Molekülorbital des Ethens beschreiben können,
- erklären können, wie die beiden pi-Molekülorbitale des Ethens zustande kommen, eventuell mit Hinweis auf die Addition und Subtraktion von Wellen,
- am Beispiel der pi-Molekülorbitale des Ethens erklären können, was die Absorption von UV-Licht bewirkt.
Struktur
Wie Sie aus dem Chemie-Unterricht der Stufen EF und Q1 wissen, besteht das Ethen-Molekül aus zwei Kohlenstoff-Atomen, die durch eine C=C-Doppelbindung miteinander verbunden sind. Jedes C-Atom ist darüber hinaus mit zwei H-Atomen verbunden, so dass wir auf die Summenformel C2H4 kommen.
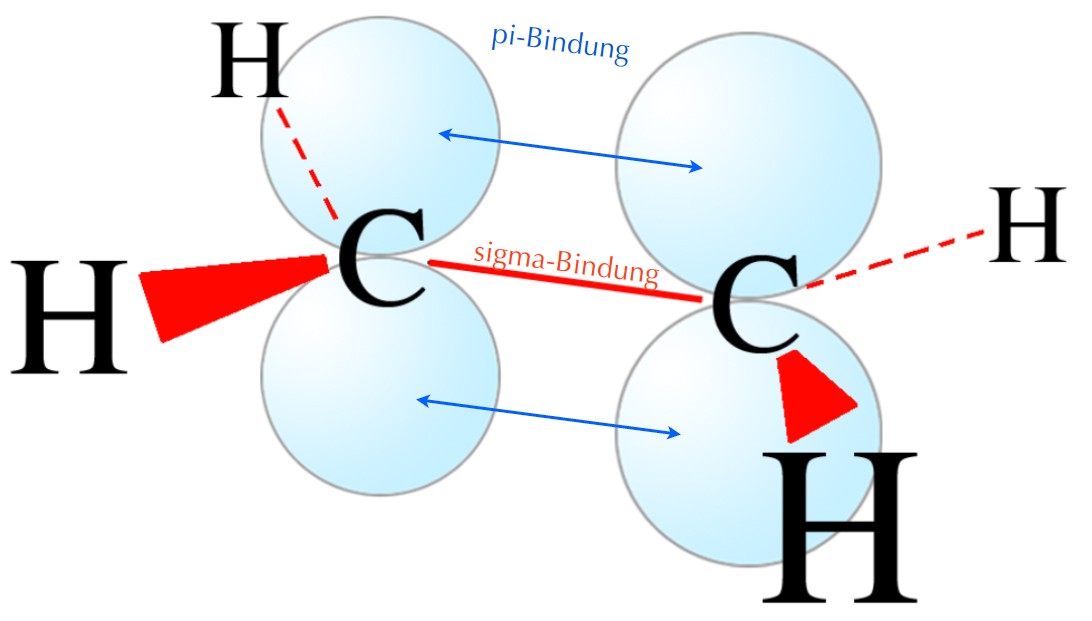
Das Ethen-Molekül nach dem Orbital-Modell
Hier sehen wir das Ethen-Molekül, so wie es sich im Orbital-Modell darstellt. Gut zu sehen sind die vier Sigma-Bindungen zwischen den C- und H-Atomen sowie die Sigma-Bindung zwischen den beiden C-Atomen (rot gezeichnet). Da beide C-Atome sp2-hybridisiert sind und sich die pz-Orbitale leicht überlappen, ist das Ethen-Molekül planar, und alle sechs Atome liegen in einer Ebene.
Die meisten Bilder auf dieser Seite habe ich übrigens alle dem Foliensatz "Farbstoffchemie 1 -Grundlagen" entnommen, den Sie von mir gegen eine kleine Kostenbeteiligung erhalten können.
Molekül-Orbitale des Ethens
Nach der MO-Theorie (Molekülorbital-Theorie) bilden überlappende Atomorbitale bei einer kovalenten Bindung sogenannte Molekülorbitale, abgekürzt MOs. Für jedes Atomorbital entsteht nach der MO-Theorie auch ein Molekülorbital. Bei dem Ethen-Molekül überlappen bei der Bildung der pi-Bindung zwei pz-Orbitale, also entstehen auch zwei MOs, ein bindendes und ein anti-bindendes.
Das bindende MO des Ethens
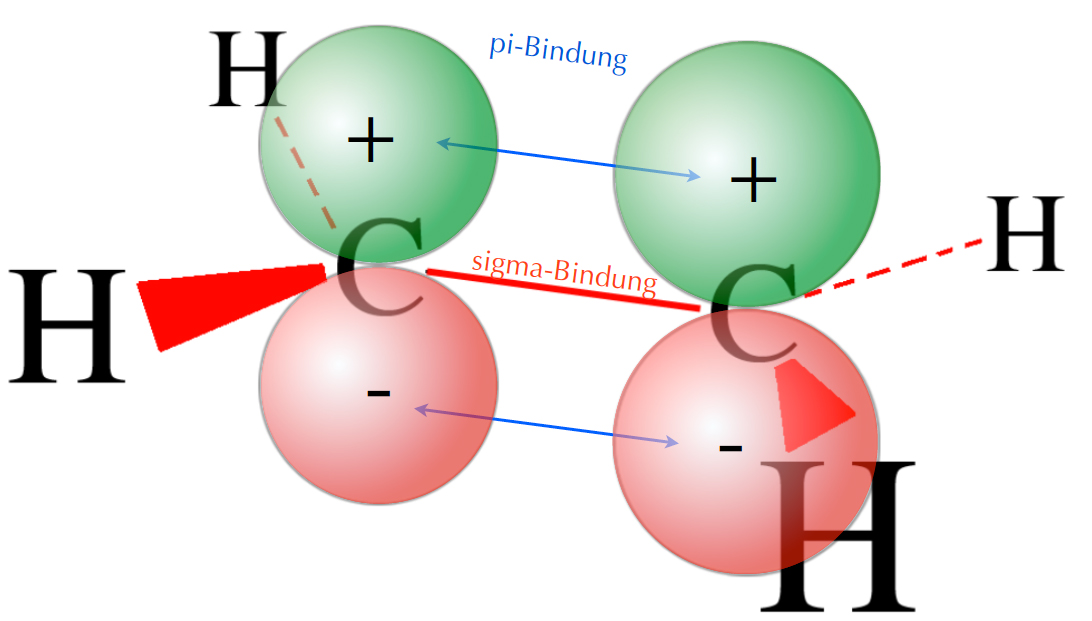
Das bindende Molekül-Orbital des Ethen-Moleküls
Auf diesem Bild sind die Orbitallappen der beiden pz-Orbitale in der gleichen Richtung orientiert. Eine Überlappung der beiden pz-Orbitale liefert daher ein bindendes π-Molekülorbital (MO). In diesem MO halten sich die beiden π-Elektronen auf. Die Plus- und Minus-Zeichen stehen nicht für eine elektrische Ladung, sondern sind mehr als "Wellenbauch" und "Wellental" zu verstehen. Vielleicht wird das auf dem folgenden Bild besser deutlich:
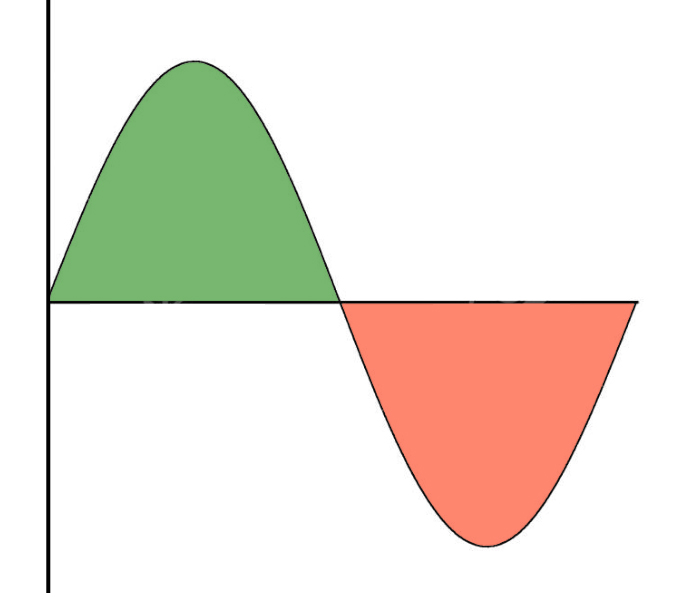
Sinuswelle mit einem Wellenberg und einem Wellental. Gleiche Farben wie auf dem Bild zuvor.
Nach den aktuellen Vorstellungen der physikalischen Chemie sind die Atomorbitale, die wir aus dem Chemieunterricht kennen, also die s-Orbitale und die p-Orbitale, nichts anderes als Lösungen einer sogenannten Wellenfunktion oder Wellengleichung (Schrödinger lässt grüßen). In meinem eigenen Unterricht vergleiche ich das immer mit dem Schwingen einer Gitarrensaite. In der normalen "Grundstellung" hat die Seite einen Wellenbauch in der Mitte, wenn sie schwingt. Hält man die Saite aber genau in der Mitte fest, während man sie zupft, entsteht ein sogenannter Flageolett-Ton. Die Seite hat dann zwei Wellenbäuche. Ähnlich verhält es sich mit den Atomorbitalen. Die s-Orbitale entsprechen dem Grundzustand einer Gitarrensaite (ein Schwingungsbauch), die p-Orbitale entsprechen dem ersten angeregten Zustand einer Saite (zwei Schwingungsbäuche). Mit dem Unterschied, dass eine schwingende Gitarrensaite eine ein-dimensionale Welle darstellt, während ein Atomorbital eine drei-dimensionale schwingende Welle ist. Ich weiß - das ist jetzt alles extrem stark vereinfacht. Wer es genauer wissen will, muss auf die entsprechenden Physik-Saiten, ich meine natürlich Physik-Seiten, gehen.
Das anti-bindende MO des Ethens
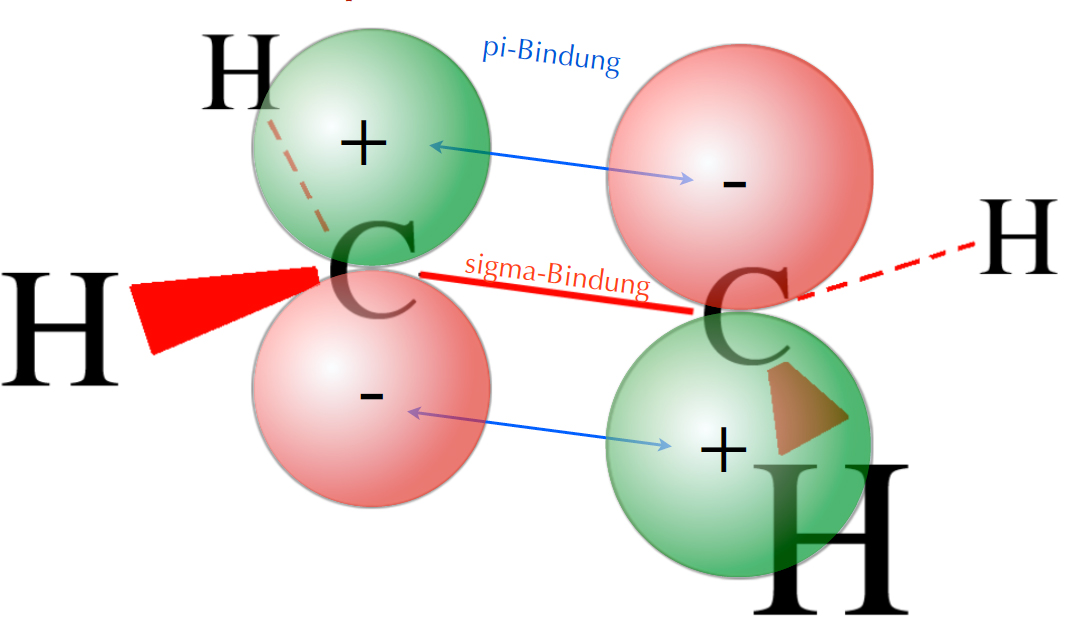
Das anti-bindende Molekül-Orbital des Ethen-Moleküls
Auf diesem Bild sind die Orbitallappen der beiden pz-Orbitale nicht in der gleichen Richtung orientiert. Eine Überlappung der beiden pz-Orbitale ist daher nicht möglich bzw. wird in der Fachliteratur als negative Überlappung bzw. Außer-Phase-Überlappung bezeichnet (Vollhardt/Schore 2020). Das Ergebnis dieser negativen Überlappung ist ein sogenanntes anti-bindendes π-Molekülorbital.
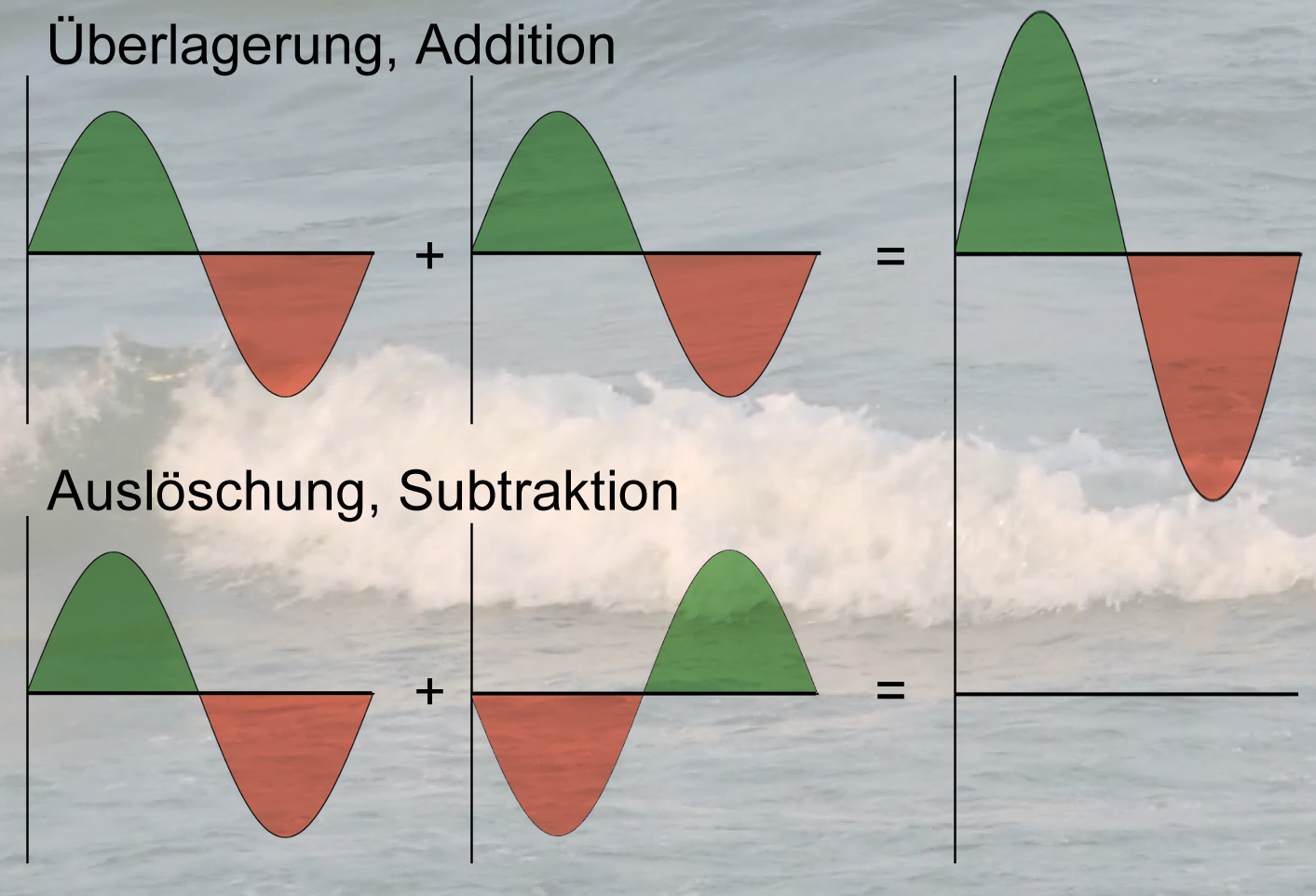
Sinuswelle mit einem Wellenberg und einem Wellental. Gleiche Farben wie auf dem Bild zuvor.
Dieses Bild zeigt im oberen Abschnitt zwei Wellen, die sich überlagern bzw. addieren, es entsteht eine größere Welle mit einem höheren Wellenberg und einem tieferen Wellental. So ähnlich muss man sich das auch vorstellen, wenn zwei pz-Orbitale überlappen, die gleich ausgerichtet sind, also wo beide +-Lappen in die gleiche Richtung weisen.
Im unteren Abschnitt zeigt das Bild zwei Wellen, die sich gegenseitig auslöschen. Das Resultat ist ein völliges Verschwinden dieser Welle. So ähnlich ist das, wenn sich zwei pz-Orbitale überlappen, die in entgegengesetzter Richtung ausgerichtet sind, wenn also der eine Plus-Lappen mit dem Minus-Lappen des anderen Orbitals zusammenkommt.
Energieschema der MOs
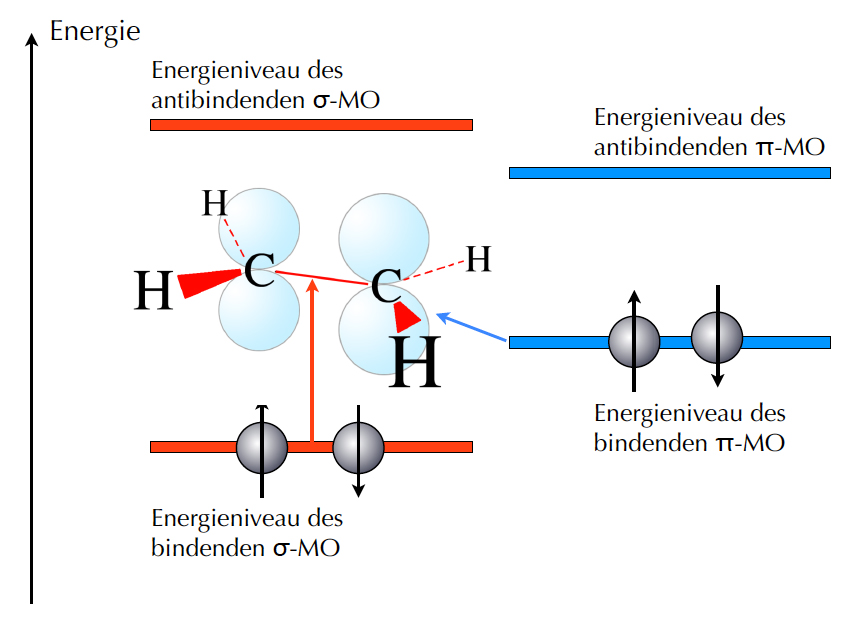
Die Energieniveaus der Molekülorbitale des Ethens
Auf diesem Bild sehen wir die Energieniveaus der Molekülorbitale (MOs) der C=C-Doppelbindung des Ethens. Links sehen wir die beiden sigma-Orbitale, das bindende und das anti-bindende, und rechts die beiden π-Orbitale, ebenfalls ein bindendes und ein anti-bindendes. Für die Farbstoffchemie sind eigentlich nur die π-Orbitale von Interesse, daher werden wir im Folgenden die sigma-Orbitale nicht mehr berücksichtigen.
Die π-MOs werden nun mit Elektronen besetzt, und zwar so, dass "von unten" angefangen wird, also beim energetisch günstigsten Molekülorbital. Da nur zwei π-Elektronen zur Verfügung stehen, wird nur das bindende π-MO besetzt. Käme noch ein drittes Elektron dazu, würde auch das anti-bindende MO besetzt. Das ist aber normalerweise nicht der Fall.
Absorption von UV-Licht
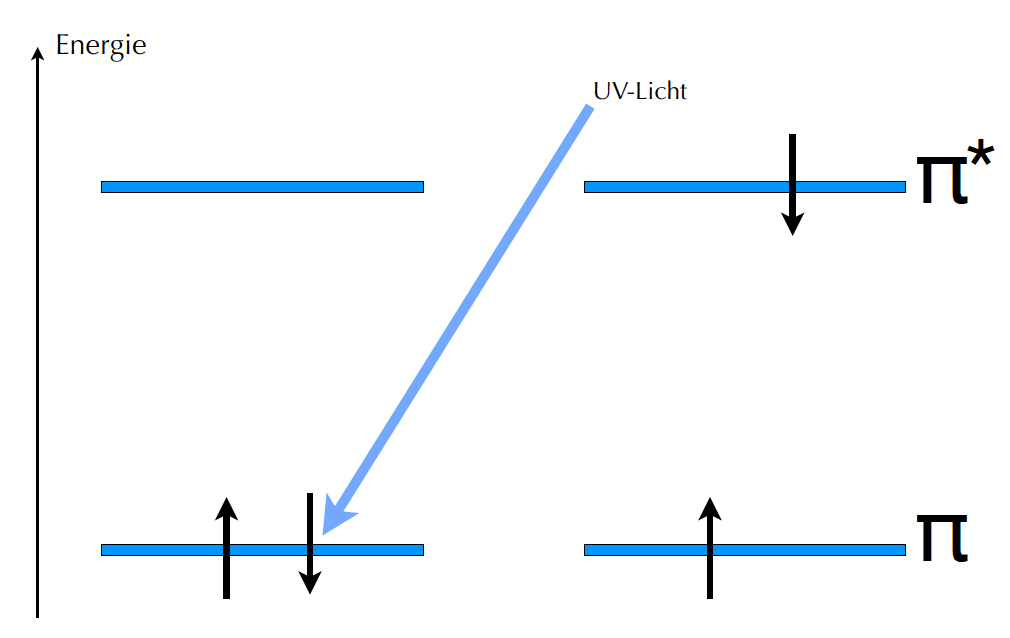
Durch UV-Licht kann ein Elektron "befördert" werden
Durch UV-Licht der Wellenlänge 171 nm[1] kann jetzt eines der beiden π-Elektronen angeregt werden, aus dem bindenden in das anti-bindende π*-Orbital zu springen. Danach ist dann sowohl das bindende wie auch das anti-bindende Orbital mit je einem Elektron besetzt. Energiemäßig befindet sich das System jetzt wieder bei Null, denn der stabilisierende Beitrag des bindenden MOs ist genau so groß wie der destabilisierende Beitrag des anti-bindenden MOs. Die bindende Wirkung des π -Orbitals wird durch das besetzte π*-Orbital also aufgehoben.
Durch die UV-Absorption wird die π-Bindung somit gespalten, die beiden C-Atome des Ethens werden nur noch durch die sigma-Bindung zusammen gehalten.
Seitenanfang -
Weiter mit dem Butadien-Molekül…