Drei kleine Versuche
Wie immer in dieser Abteilung der Chemieseiten führen wir zunächst einen kleinen Versuch durch, den wir anschließend ausführlich besprechen.
Schauen Sie sich die Versuchsanleitung und die Beobachtungen an, und dann kommen Sie bitte wieder zurück auf diese Seite.
Der Versuch kann auch schön als Demonstrationsversuch durchgeführt werden:
In diesem Versuch wird gasförmiges Chlor eingesetzt. Dazu benötigt man entweder eine Chlorgasflasche oder man muss sich das Chlorgas selbst herstellen aus Kaliumpermanganat und konz. Salzsäure.
Erklärung der Versuchsergebnisse
Schauen wir uns noch einmal die Ergebnisse des Demonstrationsversuchs an:
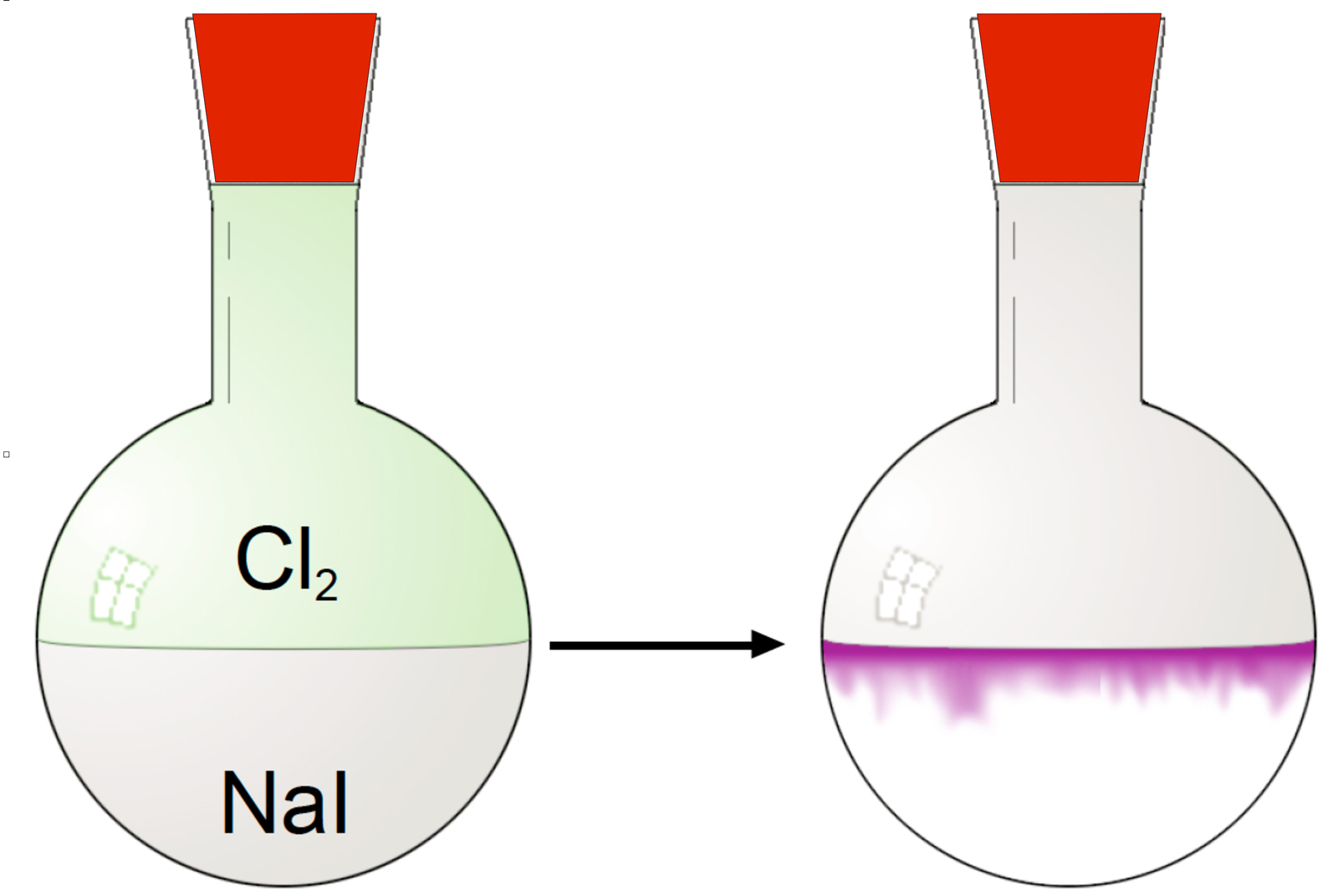
Beobachtungen bei dem Demonstrationsversuch
Autor: Ulrich Helmich 2012, Lizenz: Public domain
Wie kann man nun die Bildung der rot-violetten Schlieren in der Natriumiodid-Lösung erklären?
Es hat folgende Reaktion stattgefunden:
$2 \ I^{-} \to I_2 + 2 \ e^{-}$
$Cl_{2} + 2 \ e^{-} \to 2 \ Cl^{-}$
Die Iodid-Ionen haben je ein Elektron abgegeben, sind also oxidiert worden, und die Chlor-Moleküle haben je zwei Elektronen aufgenommen, sind also reduziert worden.
Erkennen Sie die Analogie zu der folgenden Reaktion?
$Fe \to Fe^{2+}+ 2 \ e^{-} $
$Cu^{2+} + 2 \ e^{-} \to Cu$
Die Umsetzung der Iodid-Ionen mit dem Chlorgas ist eine Redoxreaktion, eine Elektronenübertragungsreaktion, genau wie die Umsetzung von Eisen-Atomen mit Kupfer-Ionen bei dem Eisennagel-Versuch.
Den Eisennagel-Versuch hatten wir dann erweitert indem wir einen Kupfernagel in eine Silbernitrat-Lösung gestellt haben. Mit weiteren Versuchen dieser Art konnten wir dann eine Redoxreihe oder Spannungsreihe der Metalle aufstellen.
Auch bei den Halogenen kann man eine solche Spannungsreihe erstellen. Schauen wir uns die Versuchsergebnisse des ersten Versuchs noch einmal näher an:
Natriumiodid ergibt mit Chlorwasser eine violette Färbung. Das Chlor ist hier als Elektronenakzeptor aufgetreten, das Iodid als Elektronendonator.
Natriumbromid ergibt mit Chlorwasser eine braune Färbung. Auch hier ist das Chlor als Elektronenakzeptor aufgetreten, das Bromid als Elektronendonator.
Dass Natriumchlorid nicht mit Chlorwasser reagiert, sollte offensichtlich sein. Das ist das Gleiche, als wenn wir einen Eisennagel in eine Eisensulfat-Lösung stellen würden. Auf molekularer Ebene finden Reaktionen statt, auf makroskopischer Ebene ist aber nichts zu beobachten.
Die Spannungsreihe der Halogene
Bei dem Eisennagel-Versuch hatten wir die Reaktion so erklärt, dass das Eisen ein negativeres Redoxpotenzial hat als das Kupfer. Das Eisen ist daher eher geneigt, Elektronen abzugeben, während Kupfer-Ionen eher geneigt sind, Elektronen aufzunehmen. Daher fließen die Elektronen vom Elektronen-Donator Fe zum Elektronen-Akzeptor Cu2+. Stellt man einen Kupfernagel in eine Eisensulfat-Lösung, passiert nichts. Die Elektronen können nicht "bergauf" vom Kupfer zum Eisen fließen.
Bei den Nichtmetallen Chlor, Brom und Iod scheint es sich ähnlich zu verhalten. Wenn man weitere Versuche in der Art des oben beschriebenen Versuchs durchführt, dann kommt man zu folgenden Ergebnissen:
- Iodid-Ionen können Elektronen an Chlor- und an Brom-Moleküle abgeben.
- Bromid-Ionen können Elektronen an Chlor-Moleküle abgeben, nicht aber an Iod-Moleküle.
- Chlorid-Ionen können keine Elektronen an Brom- oder Iod-Moleküle abgeben.
Offensichtlich gibt es auch hier eine Redoxreihe, und die Elektronen können nicht beliebig von einem Nichtmetall-Ion auf die Atome eines anderen Nichtmetalls übertragen werden.
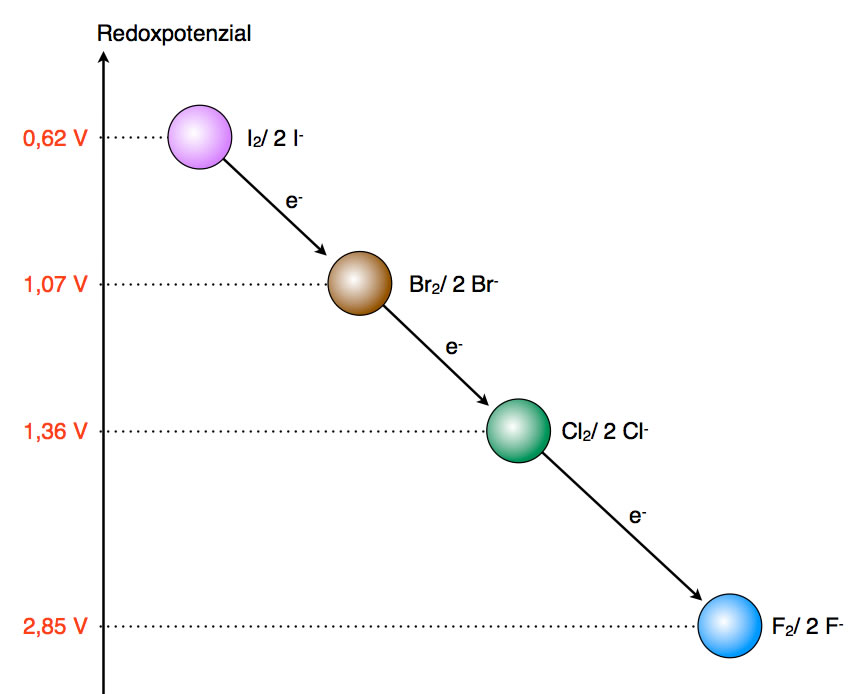
Die Spannungsreihe der Halogene
Autor: Ulrich Helmich 2012, Lizenz: Public domain.
Auf diesem Bild sehen Sie die Spannungsreihe der vier Halogene. Iodid-Ionen haben das "höchste" Redoxpotenzial, sie können Elektronen an Brom- und Chlor-Moleküle abgeben, und auch an Fluor-Moleküle. An zweiter Stelle stehen die Bromid-Ionen, sie können Elektronen an Chlor- und Fluor-Moleküle abgeben, nicht aber an Iod-Moleküle.
Bau einer Brom-Halbzelle
Die Abbildung 2 zeigt nicht nur die Spannungsreihe der vier Halogene, sondern auch deren Redoxpotenziale.
Wie kann man nun die genauen Werte der Redoxpotenziale der Halogene ermitteln?
Im Prinzip genau so, wie man die Redoxpotenziale der Metalle ermittelt: Wir bauen uns ein galvanisches Element aus zwei Halbzellen. Die eine Halbzelle hat ein bekanntes Redoxpotenzial, die andere Halbzelle ist die Iod-, Brom- oder Chlorhalbzelle, deren Redoxpotenzial wir bestimmen wollen. Die entscheidende Frage ist allerdings: Wie baut man eine Iod-, Brom- oder Chlorhalbzelle?
Auf dieser Seite ist die Versuchsdurchführung genau beschrieben, auch die Beobachtungen werden kurz dargestellt.
Elektrolysen sollten aus der Jahrgangsstufe 8 oder 9 bekannt sein. Falls nicht, hier noch einmal das Wesentliche kurz zusammengefasst:
Chemie-Nachhilfe:
Die im Wasser gelösten Zink-Ionen werden vom Minuspol angezogen, wo Elektronenüberschuss herrscht. Dort nehmen die zweifach positiv geladenen Zink-Ionen je zwei Elektronen auf und werden zu Zink-Atomen:
$Zn^{2+}+ 2 e^{-} \to Zn$
Die im Wasser gelösten Bromid-Ionen werden vom Pluspol angezogen, wo Elektronenmangel herrscht. Die negativen Bromid-Ionen geben je ein Elektron an den Pluspol ab und werden zu Brom-Atomen:
$2 Br^{-} \to 2 Br + 2 e^{-} $
Je zwei Brom-Atome vereinigen sich dann zu einem Brom-Molekül.
Nach der Elektrolyse der ZnBr2-Lösung tauscht man die Gleichspannungsquelle gegen ein Voltmeter aus und beobachtet eine Spannung von über 1 Volt. Die meisten Schüler(innen) stehen dann mit offenem Mund da und staunen. Wo kommt plötzlich diese Spannung her?
Was wir hier gemacht haben, ist im Grunde total einfach: Wir haben ein galvanisches Element erzeugt, dass aus einer Zink-Halbzelle und einer Brom-Halbzelle besteht:
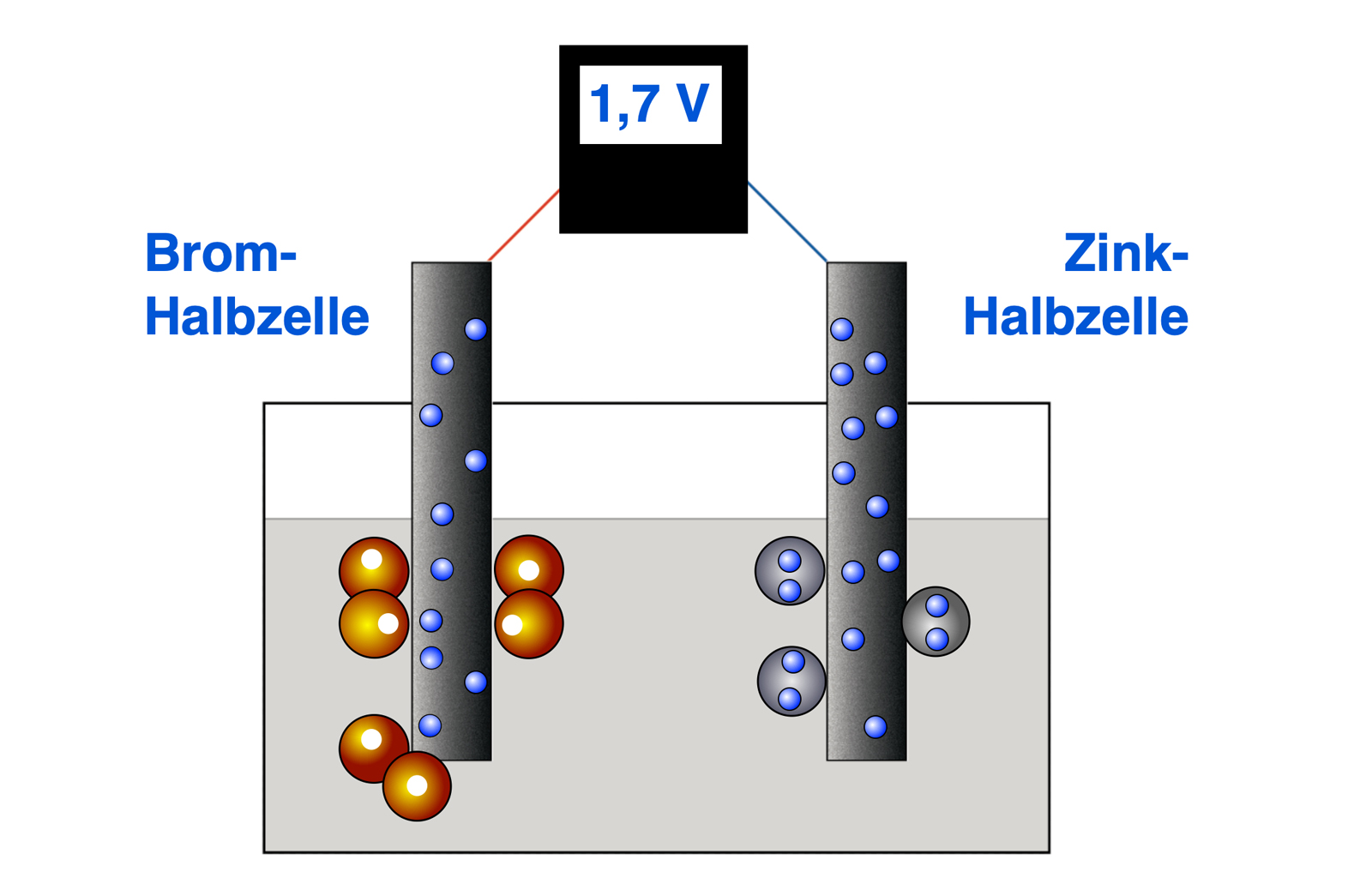
Bildung einer Brom-Elektrode
Autor: Ulrich Helmich 2016, Lizenz: Public domain
Durch die Elektrolyse hat sich die eine Kohle-Elektrode mit einer Zinkschicht überzogen, die andere Kohle-Elektrode mit einer Schicht aus gelöstem Brom. Die so veränderten Elektroden wirken nun wie eine Zink-Halbzelle bzw. wie eine Brom-Halbzelle. Wenn man die beiden Halbzellen über ein Voltmeter verbindet, kann man eine überraschend hohe Spannung beobachten.
Wie können wir mit diesem Versuch nun das Redoxpotenzial von Brom ermitteln?
Ermittlung des Redoxpotenzials vom Brom
Schritt 1
In welcher Richtung fließen hier die Elektronen? Wer spielt die Rolle des Elektronen-Donators, wer die Rolle des Elektronen-Akzeptors?
Betrachten wir dazu einfach mal die Reaktion zwischen Zink und Brom, wie sie im Reagenzglas abläuft:
$Zn \to Zn^{2+} + 2 e^{-} $
$Br_{2} + 2 e^{-} \to 2 Br^{-}$
Die Zink-Atome geben je zwei Elektronen ab, die Brom-Moleküle nehmen je zwei Elektronen auf. Es werden also Elektronen vom Zink auf die Brom-Moleküle übertragen. Zink ist hier der Elektronen-Donator, Brom der Elektronen-Akzeptor.
Bei unserer umgekehrten Elektrolyse geben die Zink-Atome der Zink-Halbzelle ebenfalls je zwei Elektronen ab; Zink ist hier also der Elektronen-Donator. Und die Brom-Moleküle der Brom-Halbzelle, die sich durch die Elektrolyse der ZnBr2-Lösung gebildet haben, nehmen diese Elektronen dann auf; Brom ist also der Elektronen-Akzeptor.
Die Zink-Halbzelle stellt also als Donator-Halbzelle den Minuspol dar, die Brom-Halbzelle als Akzeptor-Halbzelle den Pluspol.
Schritt 2
Wie berechnet man jetzt das Redoxpotenzial von Brom?
Zink bzw. das System Zn2+(aq)/Zn(s) hat ein Standard-Redoxpotenzial von -0,76 V. Da die Zink-Halbzelle die Donator-Halbzelle ist, muss die Brom-Halbzelle ein positiveres Redoxpotenzial besitzen als die Zink-Halbzelle, da die Elektronen immer zu dem Redoxsystem mit dem positiveren Redoxpotenzial fließen.
Wir können am Voltmeter eine Spannung von über 1 Volt ablesen, im Idealfall sogar 1,83 Volt. Diese Spannung addieren wir nun zu den -0,76 Volt der Zink-Halbzelle und erhalten +1,07 Volt. Dies ist dann das Redoxpotanzial der Brom-Halbzelle bzw. des Systems Br2/2 Br-.
Edle und unedle Metalle und Nichtmetalle
Metalle
Metalle haben nur wenige Außenelektronen. Um in den Edelgaszustand zu kommen, ist der Weg des geringsten Widerstands daher, die Außenelektronen abzugeben. Unedle Metalle wie Natrium oder Calcium geben diese Außenelektronen recht "gern" ab, während edle Metalle wie Kupfer oder Silber die Außenelektronen nicht so leicht hergeben.
- Unedle Metalle = negatives Redoxpotenzial
- Edle Metalle = positives Redoxpotenzial
Nichtmetalle
Nichtmetalle haben viele Außenelektronen, sie müssen nur noch wenige Elektronen aufnehmen, um in den Edelgaszustand zu gelangen. Die Halogene wie Chlor und Brom müssen sogar nur ein einziges Elektron aufnehmen. Die Halogene sind daher sehr reaktiv und somit "unedel". Umgekehrt gilt für die Halogene, dass sie ein einmal aufgenommenes Elektron nicht mehr "herausrücken" wollen. Das Redoxpotenzial (die Fähigkeit zur Abgabe von Elektronen) ist also nicht besonders groß. Mathematisch korrekt muss man sagen, das Redoxpotenzial der Halogene ist stark positiv.
- Unedle Nichtmetalle = stark positives Redoxpotenzial
- Edle Nichtmetalle = weniger stark positives Redoxpotenzial
Iodid-Ionen sind die Teilchen unter den Halogenen, die am liebsten Elektronen abgeben und zu Iod-Molekülen werden. Sie haben also das am wenigsten positive Redoxpotenzial. Wäre Iod jetzt ein Metall, müsste man es als "unedel" bezeichnen. Bei Nichtmetallen, die ja die Aufnahme von Elektronen anstreben, ist es aber genau umgekehrt. Hier ist Iod das "edelste" der Halogene".
Für Experten
Warum ist Iod "edler" als Brom und die anderen Halogene bzw. hat das kleinste Redoxpotenzial aller Halogene?
Die Iod-Atome sind sehr groß, Iod hat fünf Elektronenschalen. Die Außenelektronen eines Iodid-Anions werden vom Atomkern also nicht so stark angezogen wie die Außenelektronen eines Bromid-Ions. Iodid-Ionen geben ihr überzähliges achtes Außenelektron daher leichter ab als Bromid-Ionen. Aus diesem Grund haben Iodid-Ionen ein kleineres Redoxpotenzial als Bromid-Ionen. Gibt man Iodid-Ionen mit Brom-Molekülen zusammen, so fließen Elektronen von den Iodid-Ionen zu den Bromid-Molekülen, und es bilden sich Iodid-Moleküle und Bromid-Ionen.