Beispiel einer einfachen Elektrolyse
Versuch
Elektrolyse von ZnBr2-Lösung
Durchführung (Projektionsversuch):
Wir geben etwas Zinkbromid-Lösung in ein Petrischale, die auf einem Overhead-Projektor steht, und stellen zwei Kohle-Elektroden so in die Schale, dass sie sich nicht berühren können (Kurzschlussgefahr). Die Kohleelektroden werden mit Kabeln an eine Gleichstromquelle angeschlossen, dann wird eine Gleichspannung von ca. 4 bis 5 V angelegt.

Beobachtungen:

Am Pluspol bilden sich braune Schlieren, nach einiger Zeit bemerkt man einen typischen Chlor- oder Bromgeruch. Am Minuspol bilden sich kleine Metall-Ästchen.
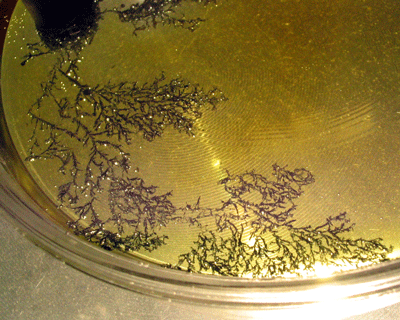
Dieses Bild zeigt den "Baum" am Minuspol nach ca. 15 Minuten. Er ist ziemlich gewachsen.
Die Deutung dieses Versuchs ist jetzt nicht besonders schwer. Beschäftigen wir uns zunächst mit den Vorgängen am Minuspol - diese sind leichter zu erklären.
Am Minuspol bildet sich metallisches Zink
Die Zinkbromid-Lösung enthält Zink-Ionen und Bromid-Ionen, also Zn2+ und Br-. Der Minuspol zieht nun die positiven Zink-Ionen an. Dort nehmen die Zink-Ionen jeweils zwei Elektronen auf, denn am Minuspol herrscht ein Elektronen-Überschuss:
$Zn^{2+}_{(aq)} + 2 e^{-} \to Zn_{(s)} \ \ \ \ (Reduktion)$Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
An dem Minuspol findet also eine Reduktion statt, bei der reines Zink entsteht.
Am Pluspol bildet sich Brom
Der Pluspol zieht die negativ geladenen Bromid-Ionen an. Am Pluspol herrscht ein Elektronen-Mangel, und die Bromid-Ionen geben je ein Elektron an den Pluspol ab:
$2 Br^{-}_{(aq)} \to Br_{2(aq)} + 2 e^{-} \ \ \ \ (Oxidation)$
Die beiden so entstandenen Brom-Atome vereinigen sich sofort zu einem Brom-Molekül Br2.
Elektrolyse von Salz-Lösungen
Salz-Lösungen enthalten positiv geladene Metall-Kationen und negativ geladene Nichtmetall-Anionen. Bei einer Elektrolyse werden diese Ionen von zwei Elektroden angezogen: Der Pluspol zieht die Anionen an und heißt daher Anode, der Minuspol zieht die Kationen an und heißt daher Kathode.
Am Pluspol herrscht Elektronenmangel. Dort geben die Nichtmetall-Anionen Elektronen ab und werden dann zu Nichtmetall-Atomen, die sich eventuell zu Molekülen zusammen lagern.
Am Minuspol herrscht Elektronenüberschuss. Dort nehmen die Metall-Kationen Elektronen auf und werden zu Metall-Atomen.
Bei einer Elektrolyse werden also mit Hilfe des elektrischen Stroms (Energieaufwand) die Salze in ihre ursprünglichen Bestandteile (Metall + Nichtmetall) zerlegt; daher auch der Name Elektro-Lyse.
Schmelzflusselektrolyse
Salze bestehen aus unterschiedlich geladenen Metall- und Nichtmetall-Ionen. Im festen Salz sind diese Ionen unbeweglich und können daher nicht mit Hilfe des elektrischen Stroms getrennt werden. Festes Natriumchlorid kann nicht elektrolysiert werden.
Erhitzt man das Salz jedoch stark, so fängt es an zu schmelzen. Die Ionen werden beweglich und können durch eine Gleichspannung getrennt werden. Eine Salzschmelze kann also elektrolysiert werden. Dabei spielen sich an den beiden Elektroden die gleichen Vorgänge ab wie bei der Elektrolyse einer Salzlösung.
Historisches
Im Jahre 1808 wurden durch Humpry DAVY die Elemente Natrium und Chlor zum ersten Mal hergestellt - und zwar durch eine Schmelzflusselektrolyse des Salzes Natriumchlorid. Viele andere Metalle und Nichtmetalle konnten seitdem durch solche Elektrolysen von Salzen entdeckt bzw. hergestellt werden.
Technische Anwendung
Elektrolysen spielen in der Industrie eine sehr wichtige Rolle. Viele Metalle und auch manche Nichtmetalle werden durch Elektrolysen gewonnen.
Zink
Zink wird zum Beispiel aus dem Mineral Zinkoxid gewonnen. Das Zinkoxid wird mit Schwefelsäure versetzt, so dass sich das Salz Zinksulfat bildet. Das gelöste Zinksulfat wird dann mit Aluminium-Elektroden elektrolysiert, um reines Zink zu gewinnen. Einzelheiten siehe "Zink-Gewinnung" im Chemie-Lexikon.
Alkalimetalle
Die Alkalimetalle (Natrium, Kalium etc.) werden technisch ebenfalls durch Elektrolysen gewonnen. Hier muss man Schmelzflusselektrolysen durchführen, denn in einer wässrigen Lösung eines Alkalisalzes würde das gebildete Natrium oder Kalium sofort mit dem Wasser weiter reagieren.
Aluminium
Auch das Metall Aluminium wird durch Schmelzflusselektrolyse gewonnen. Ausgangsstoff ist das Mineral Bauxit, aus dem zunächst Aluminiumoxid gewonnen wird. Das Aluminiumoxid wird dann geschmolzen und mit Kohle-Elektroden elektrolysiert. Einzelheiten siehe "Aluminium-Gewinnung" im Chemie-Lexikon.
Wasserstoff
Schließlich soll das Nichtmetall Wasserstoff erwähnt werden, das recht leicht durch Elektrolyse von Wasser gewonnen werden kann. Wasserstoff ist ein bedeutender Energieträger und wird beispielsweise für das Betreiben von Brennstoffzellen benötigt.
Kupfer
Kupfer wird zwar nicht durch Elektrolyse gewonnen, aber mit Hilfe einer bestimmten Elektrolyse gereinigt. Als Pluspol verwendet man Elektroden aus Rohkupfer, das mit Verunreinigungen versetzt ist. Als Minuspol verwendet man Elektroden aus hochreinem Kupfer. Beide Elektroden befinden sich in einer Lösung aus angesäuertem Kupfersulfat. Legt man eine geringe Spannung von ca. 0,3 Volt an, so löst sich der Pluspol langsam auf, denn aus den Kupfer-Atomen entstehen durch Elektronenabgabe Kupfer-Ionen, die sich in der Kupfersulfat-Lösung auflösen. Der Minuspol zieht diese Kupfer-Ionen an, und dort nehmen sie Elektronen auf, werden also reduziert. Am Minuspol scheidet sich also eine immer dicker werdende Schicht aus reinem Kupfer ab, während sich das unreine Kupfer am Pluspol auflöst. Die Verunreinigungen des Rohkupfers "bröseln" dann in die Elektrolyt-Lösung und setzen sich unten im Reaktionsgefäß ab.