Halbzellen und galvanische Elemente
Bereits im Abschnitt über galvanische Zellen hatten wir am Ende verschiedene Methoden kennengelernt, wie man ein Daniell-Element im Schulunterricht umsetzen kann. An genau dieser Stelle machen wir jetzt hier weiter …
Auf dieser Seite werden zwei Varianten des Versuchs zum Kupfer-Zink-Element beschrieben. Einmal mit zwei Bechergläsern und einer Ionenbrücke, und einmal mit einem Elektrochemie-Baukasten.
Lesen Sie sich die Versuchsführung durch und kommen Sie dann auf diese Seite zurück.
Erklärung der Spannung
Die elektrochemischen Vorgänge, die bei diesem Versuch ablaufen, hatten wir bereits beim Daniell-Element kennengelernt. Die Zink-Elektrode wird oxidiert, Zink-Ionen gehen in Lösung. An der Kupfer-Elektrode werden die Kupfer-Ionen der Lösung reduziert, und metallisches Kupfer setzt sich an der Elektrode ab.
Schauen wir uns dazu folgende Abbildung an:
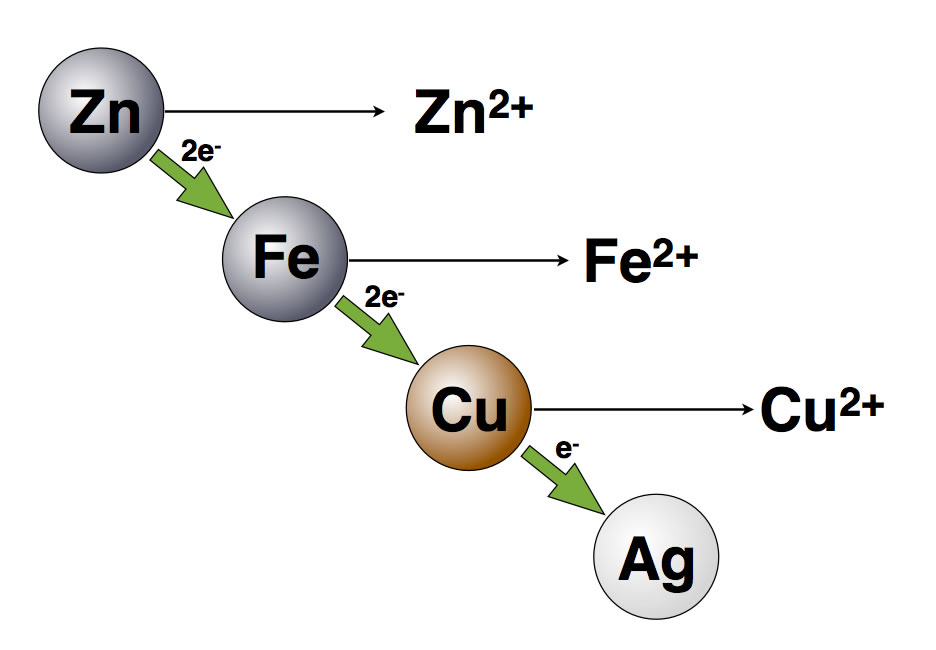
Ein Ausschnitt aus der Spannungsreihe der Metalle
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Das Zink hat ein "höheres" Redoxpotenzial als das Kupfer, gibt also leichter Elektronen ab.
Redoxpotenzial (provisorische Definition)
Das Redoxpotenzial ist ein Maß für die Fähigkeit eines Teilchens, Elektronen abzugeben (bzw. als Elektronen-Donator aufzutreten). Unedle Metalle wie Zink haben ein "hohes" Redoxpotenzial, edle Metalle wie Kupfer ein "niedriges".
"Höhere" Redoxpotenziale sind negativere Redoxpotenziale!
Wer schon etwas Ahnung von Redoxpotenzialen hat, weiß natürlich, dass mit einem "höherem" Redoxpotenzial ein negativeres gemeint ist. Unedle Metalle wie Lithium oder Magnesium haben ein Redoxpotenzial im Bereich von -2 bis -3 Volt, etwas edlere Metalle wie Eisen und Blei haben Redoxpotenziale zwischen 0 und -1 Volt, und richtige Edelmetalle wie Kupfer, Silber und Gold haben positive Redoxpotenziale.
Bei der graphischen Darstellung von Redox- oder Spannungsreihen werden jedoch die Redoxsysteme mit negativen Potenzialen immer oben eingezeichnet. Das hat sich bewährt, denn so kann man sich leichter vorstellen, wie die Elektronen "von oben nach unten" fließen, also bergab. Daher liegt es nahe, von "höheren" Redoxpotenzialen zu sprechen, wenn man eigentlich "negativere" meint.
Didaktischer Hinweis
Der didaktisch bessere Weg wäre wahrscheinlich, im Unterricht gleich darauf hinzuweisen, dass bei einer Reduktion Elektronen aufgenommen werden, und dass das Redoxpotenzial die Neigung darstellt, Elektronen abzugeben, so dass andere Teilchen reduziert werden können. Und da Elektronen negativ sind, bedeutet ein "negativeres" Redoxpotenzial eine höhere Neigung, Elektronen abzugeben / als Elektronendonator aufzutreten.
Mit dieser rein qualitativen Ordnung wollen wir uns jetzt nicht weiter zufrieden geben. Wir wollen die tatsächlichen Positionen der einzelnen Metalle in der Redoxreihe der Metalle ermitteln, um so zu einer quantitativen Ordnung zu kommen
Dummerweise kann man einzelne Redoxpotenziale mit solchen Versuchen nicht ermitteln. Wohl aber kann man die Redoxpotenzialdifferenz zweier Metalle bzw. zweier Metall-Halbzellen ermitteln. Die Redoxpotenzialdifferenz zwischen einer Standard-Kupferhalbzelle und einer Standard-Zinkhalbzelle (Definition siehe weiter unten) beträgt genau 1,1 Volt. Das ist quasi der Abstand zwischen den Metallen Zink und Kupfer in der obigen Abbildung, die wir jetzt also verbessern können:
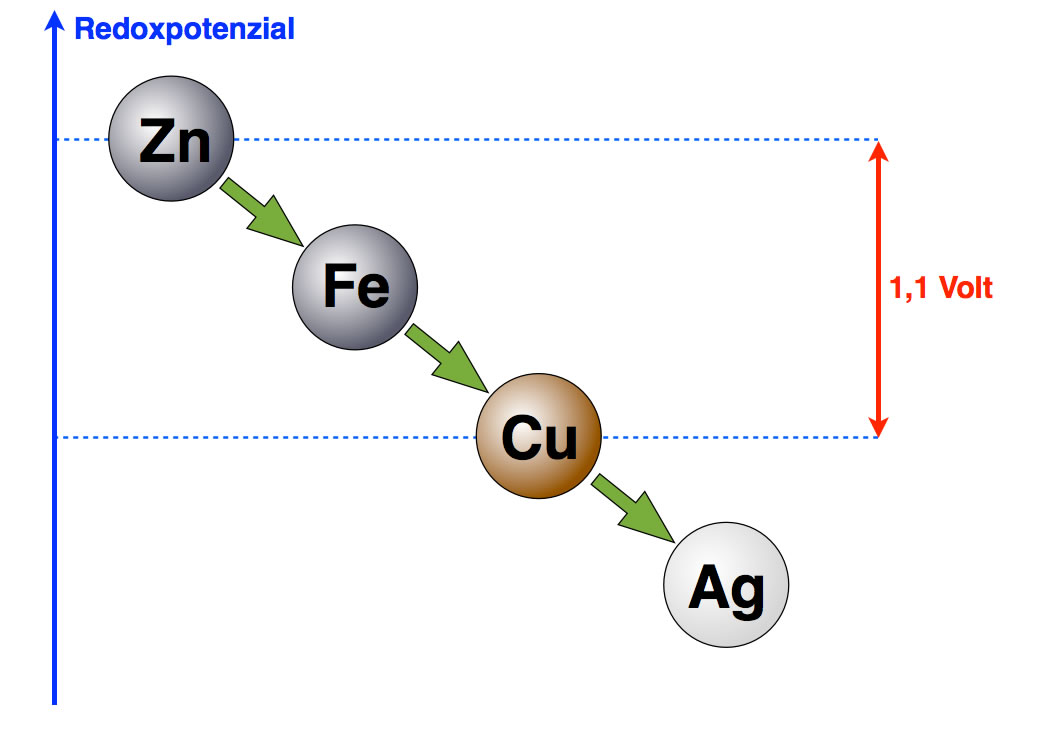
Die Potenzialdifferenz zwischen Zink und Kupfer beträgt 1,1 Volt
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Die absoluten Werte von Zink und Kupfer sind nicht bekannt, können im Prinzip auch nicht ermittelt werden. Was ermittelt werden kann, ist aber die Redoxpotenzial-Differenz, also der Unterschied zwischen den Werten der verschiedenen Metalle. Bei einem Kupfer-Zink-Element misst man unter Standardbedingungen eine Potenzialdifferenz von 1,1 Volt.
Wir wollen nun weitere Versuche dieser Art unternehmen, um auch die Redoxpotenzialdifferenzen zwischen den anderen Metallen zu ermitteln. Vorher allerdings noch zwei wichtige Definitionen:
Standard-Halbzelle
Eine Standard-Halbzelle besteht aus zwei Komponenten: Einem Metall Me, das in eine 1-molare Lösung mit Kationen Men+ des Metalls eintaucht.
Aus zwei solcher Standard-Halbzellen kann man ein galvanisches Element zusammenbauen:
Galvanisches Element
Ein galvanisches Element besteht aus zwei (Standard-) Halbzellen, die miteinander verbunden werden. Der Stromkreis muss durch eine Elektrolytbrücke oder eine permeable Membran geschlossen werden.Für quantitative Messungen müssen wir nur dafür sorgen, dass die beiden Lösungen (Kupfersulfat und Zinksulfat) eine Konzentration von c = 1 mol/l haben.
Führt man den bereits erwähnten Versuch mit der Kupfer-Zink-Zelle statt dessen mit einer Silber- und einer Zink-Halbzelle durch, dann erhält man eine Spannung von 1,56 Volt. Damit können wir unsere Graphik weiter verfeinern:
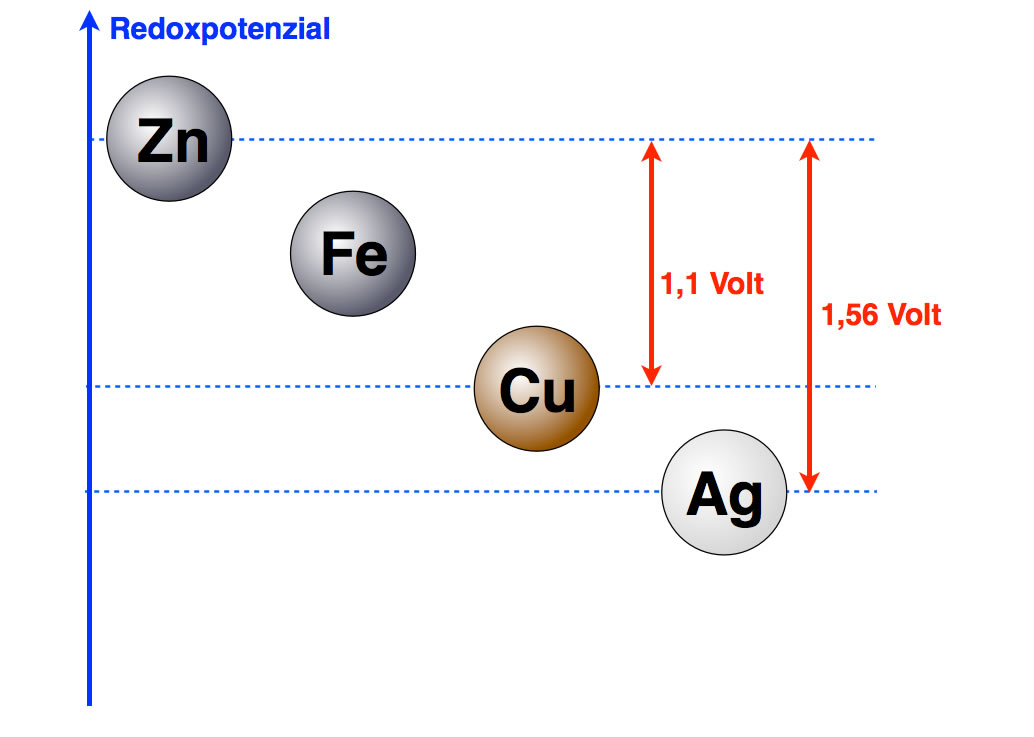
Jetzt haben wir bereits zwei Potenzialdifferenzen ermittelt
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Wenn man sich diese Graphik anschaut, kommt einem gleich die Idee für den nächsten Versuch: Wir bauen ein galvanisches Element aus einer Silber- und einer Kupfer-Halbzelle auf und messen eine Spannung von 0,46 Volt.

Die Potenzialdifferenzen verhalten sich additiv
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
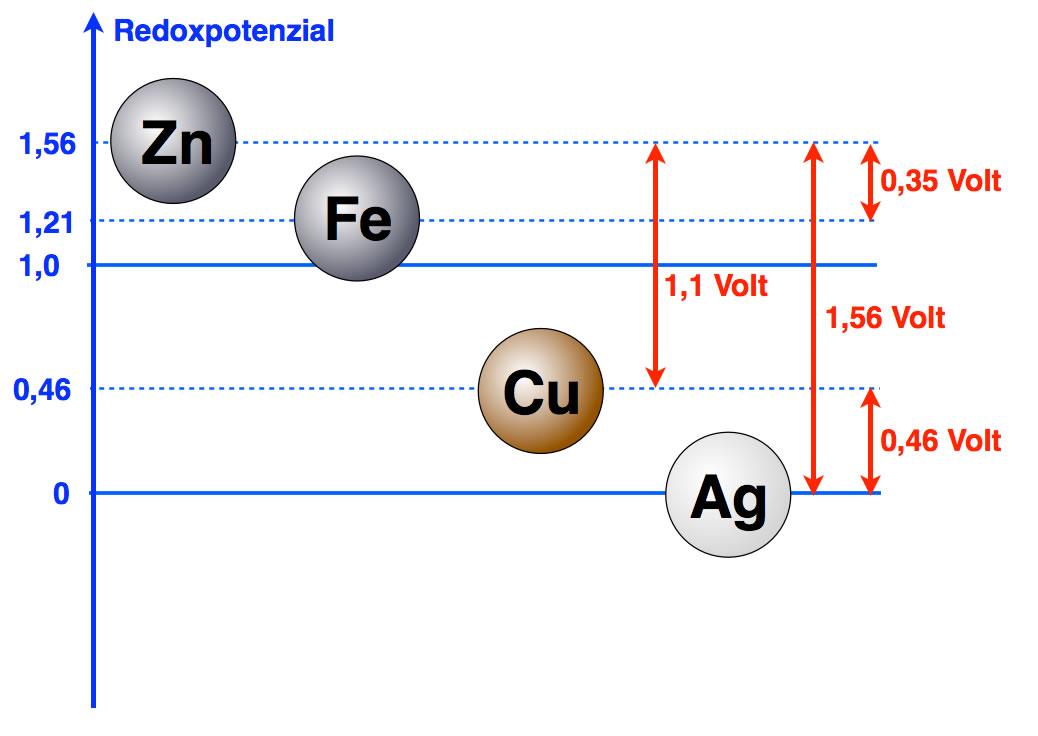
Der genaue Wert liegt zwischen 0,45 und 0,46 Volt. Das Redoxpotenzial von Eisen kann man auf die gleiche Weise ermitteln. Der Abstand zwischen Eisen und Zink beträgt dann 0,35 Volt.
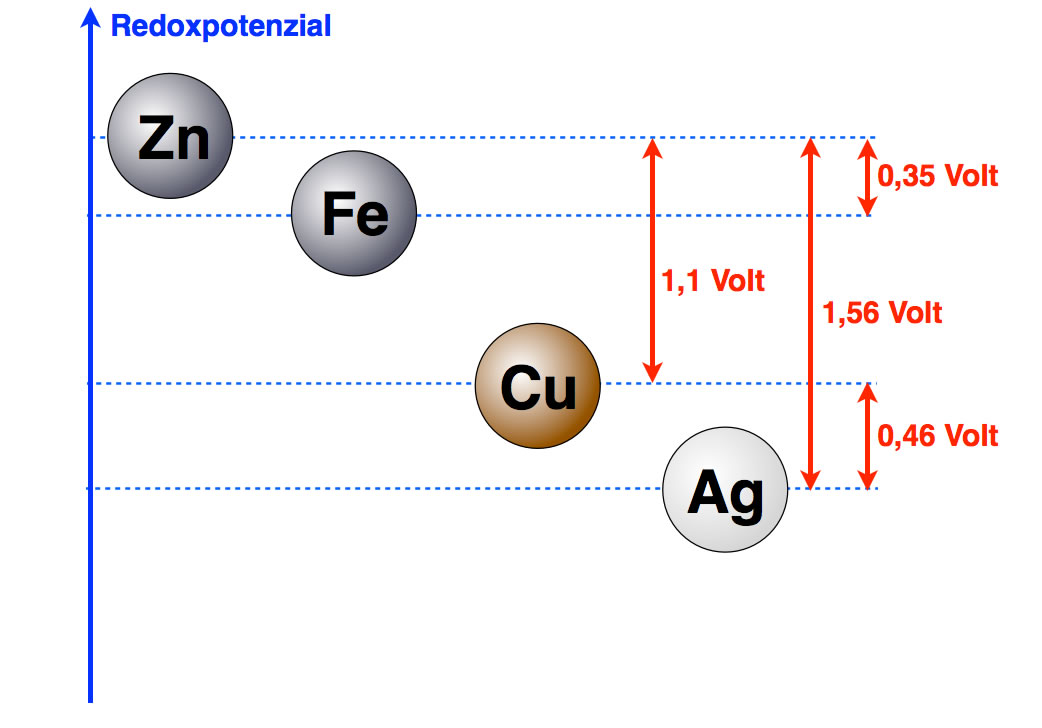
Weitere Potenzialdifferenzen in der Spannungsreihe der Metalle
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Wenn wir solche Versuche mit allen Metallen systematisch wiederholen, so erhalten wir schließlich die Spannungsreihe der Metalle.
Allerdings ist es unschön, wenn wir immer nur die Differenzen der Redoxpotenziale angeben können. Schöner wäre es, wenn wir ein Bezugssystem hätten, dem wir dann den willkürlichen Wert 0 geben könnten.
Silber wäre doch ein denkbarer Kandidat für ein solches Bezugssystem. Geben wir dem Silber doch einfach mal den willkürlichen Wert von 0. Dann hätte Kupfer ein Redoxpotenzial von 0,46 und Zink ein Redoxpotenzial von 1,56.
Die Chemiker der Welt haben sich aber nicht für Silber oder ein anderes Edelmetall als Bezugssystem entschieden, sondern für etwas völlig ungewöhniches, den Wasserstoff.
Wasserstoff ist ein gasförmiges Element und außerdem das leichteste Element überhaupt. Ein Wasserstoff-Atom besteht ja aus nur einem einzigen Proton und einem einzigen Elektron. Vielleicht war dies der Grund, denn Wasserstoff als Bezugssystem zu wählen. Wie aber ist dann eine Wasserstoff-Halbzelle aufgebaut, die ja benötigt wird, um solche Messungen durchzuführen?
Die Wasserstoff-Halbzelle
Es ist gar nicht so einfach, eine Wasserstoff-Halbzelle zu konstruieren. Rein theoretisch müsste man dazu eine Elektrode aus gefrorenem Wasserstoff-Gas verwenden, die in eine Lösung mit Protonen (Wasserstoff-Ionen) eintaucht. Eine Elektrode aus festem Wasserstoff könnte man ja noch herstellen, wenn man sich vorher warm anzieht. Aber wie soll man den gefrorenen Wasserstoff bei den eisigen Temperaturen in eine flüssige Lösung mit Protonen hineinbekommen? Keine Chance!
Daher hat man sich etwas anderes ausgedacht. Man nimmt gar keinen festen Wasserstoff, sondern festes Platin. Platin ist ein ziemlich edles Metall, das sich aus bestimmten Gründen besonders gut für die Konstruktion von solchen Elektroden eignet, besser jedenfalls als Gold (sonst würde man ja überall Gold-Elektroden einsetzen, vor allem weil Gold billiger ist als Platin).
Das Platinmetall soll aber keine Platin-Kationen abgeben, sondern ist nur eine Art Träger für gasförmigen Wasserstoff. Dieser gasförmige Wasserstoff strömt aus einer Wasserstoff-Flasche mit normalem Druck bei normaler Temperatur von unten an der Platin-Elektrode vorbei. Es bildet sich ein dünner Mantel aus Wasserstoff-Gas um das Platin, und dieser dünne Mantel ist dann die Wasserstoff-Elektrode.
Als Elektrolyt-Lösung muss man eine Flüssigkeit nehmen, die Protonen in einer Konzentration von 1 mol/l enthält. Am besten eignet sich dafür Salzsäure der Konzentration c(HCl) = 1 mol/l.
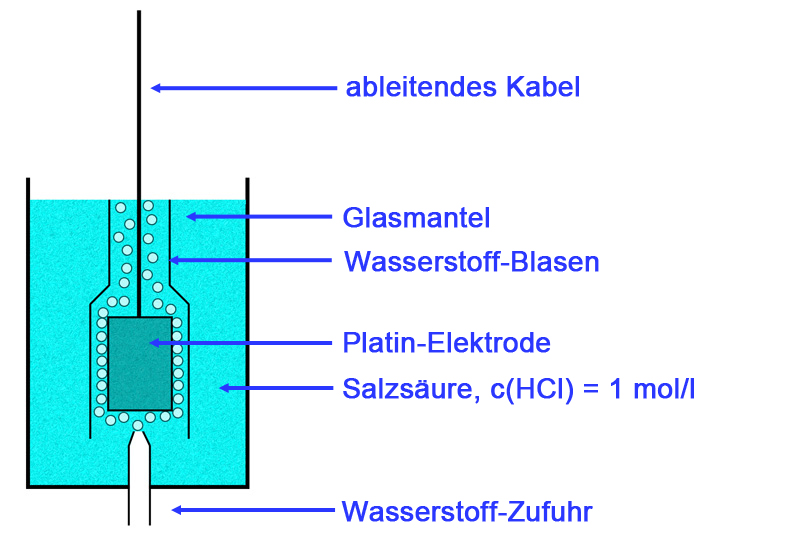
Schematische Darstellung einer Wasserstoff-Halbzelle
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Die Skizze stellt eine Wasserstoff-Elektrode oder -Halbzelle dar. Von unten strömt Wasserstoff-Gas um eine Platin-Elektrode, die Gasbläschen bilden eine Art Mantel um das Metall herum, welcher dann die eigentliche Elektrode darstellt. Echte Wasserstoff-Elektroden sind natürlich etwas anders aufgebaut als die hier abgebildete, aber das Prinzip stimmt schon.
Die Spannungsreihe der Metalle

Ein größerer Ausschnitt aus der Spannungsreihe der Metalle
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Hier sehen wir nun eine Darstellung der sogenannten Spannungsreihe der Metalle mit der Wasserstoff-Halbzelle als Bezugssystem.
Wenn man genau hinschaut, stellt man fest, dass Metalle wie Zink oder Natrium jetzt eigentlich kein "hohes" Redoxpotenzial mehr haben, sondern ein ziemlich niedriges, nämlich ein negatives. Trotzdem positioniert man die unedlen Metalle oben in solchen Abbildungen, um zu demonstrieren, dass sie gern Elektronen abgeben, die dann "nach unten fallen" bzw. "bergab" strömen.
Redoxpotenzial (endgültige Definition)
Das Redoxpotenzial ist ein Maß für die Fähigkeit eines Teilchens, Elektronen abzugeben. Unedle Metalle wie Zink haben ein stark negatives Redoxpotenzial, edle Metalle wie Kupfer ein positives.
Das Redoxpotenzial wird in Volt angegeben, wobei die Wasserstoff-Halbzelle des Bezugssystem ist.
Wenn ein Metall wie Calcium also beispielsweise ein Redoxpotenzial von -2,87 Volt hat, so bedeutet das Folgendes: Wenn wir eine Standard-Calcium-Halbzelle mit einer Standard-Wasserstoff-Halbzelle verbinden, so erhält man eine Spannung von -2,87 Volt, wobei die Calcium-Halbzelle den Minuspol und die Wasserstoff-Halbzelle den Pluspol bildet.
Wieso bildet die Calcium-Halbzelle hier den Minuspol?
Calcium hat ein negativeres Redoxpotenzial als Wasserstoff. Bei der elektrochemischen Reaktion wird das Calcium also oxidiert und gibt Elektronen ab. Die Oxonium-Ionen in der Wasserstoff-Halbzelle werden dagegen reduziert, nehmen also Elektronen auf und werden zu Wasser und Wasserstoff.