Alkene können durch Chlorwasserstoff HCl, Bromwasserstoff HBr oder Iodwasserstoff HI in die entsprechenden Halogenalkane überführt werden [4]. Auf dieser Seite werden wir uns schwerpunktmäßig mit der Hydrobromierung befassen, also der Addition von HBr an die C=C-Doppelbindung eines Alkens. Die meisten Erkenntnisse, die wir hierbei gewinnen, können aber mehr oder weniger direkt über die beiden anderen Reaktionen übertragen werden. Laut [4] werden die meisten Hydrohalogenierungen in der Gasphase durchgeführt, damit kein Lösemittel wie Wasser oder Alkohol mit der Doppelbindung reagieren kann.
Hydrobromierung in der Gasphase
In der Gasphase ist das HBr-Molekül ein starker permanenter Dipol. Kommt hier ein HBr-Molekül in die Nähe einer C=C-Doppelbindung, werden die Elektronen der pi-Bindung von dem positiven Pol (dem H-Atom) des HBr-Moleküls leicht angezogen.
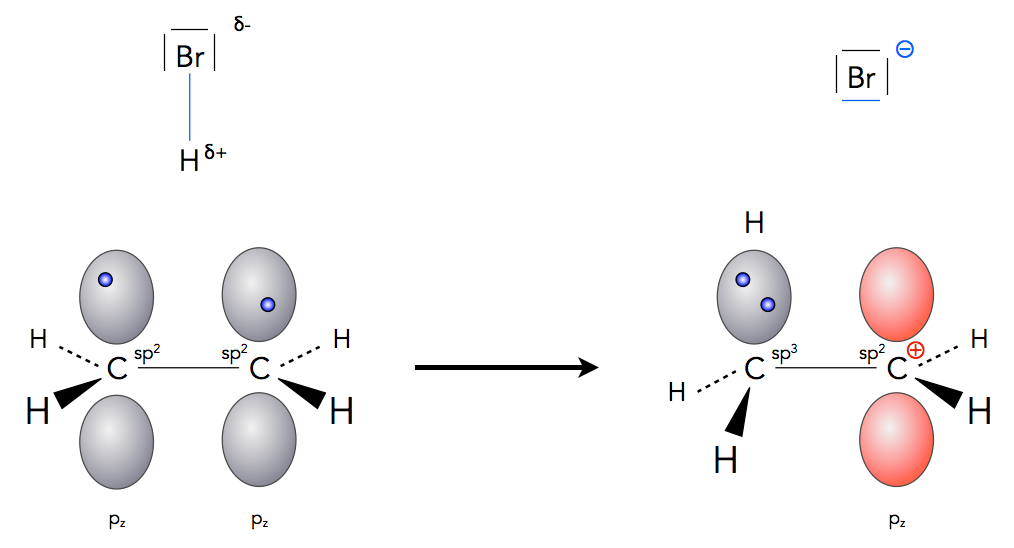
Die Bildung des Carbenium-Ions bei der Hydrobromierung in der Gasphase
Autor: Ulrich Helmich 2020, Lizenz: Public domain.
Schließlich wird das HBr-Molekül heterolytisch gespalten, und das leere 1s-Orbital des entstandenen Protons überlappt mit dem einfach besetzten pz-Orbital eines C-Atoms der Doppelbindung. Das Elektron des zweiten pz-Orbitals verbleibt dann ebenfalls in der neu gebildeten C-H-Bindung, so dass das zweite pz-Orbital jetzt leer ist. Es ist ein Carbenium-Ion entstanden (rechts im Bild zu sehen).
In der Gasphase gibt es keine Lösemittel, die das Carbenium-Ion stabilisieren können, auch das Bromid-Anion kann hier nicht stabilisiert werden.
Im zweiten Schritt setzt sich ein Bromid-Ion an das Carbenium-Ion, und die Reaktion ist mit der Bildung des Endproduktes abgeschlossen.
Hydrobromierung in wässriger Lösung
Löst man Bromwasserstoff in Wasser oder einem anderen polaren Lösemittel, so dissoziiert das HBr-Molekül heterolytisch, und es bilden sich Oxonium-Ionen und Bromid-Anionen. Die H3O+-Ionen setzen sich als Elektrophile an die C=C-Doppelbindung des Alkens und spalten ein Proton ab.
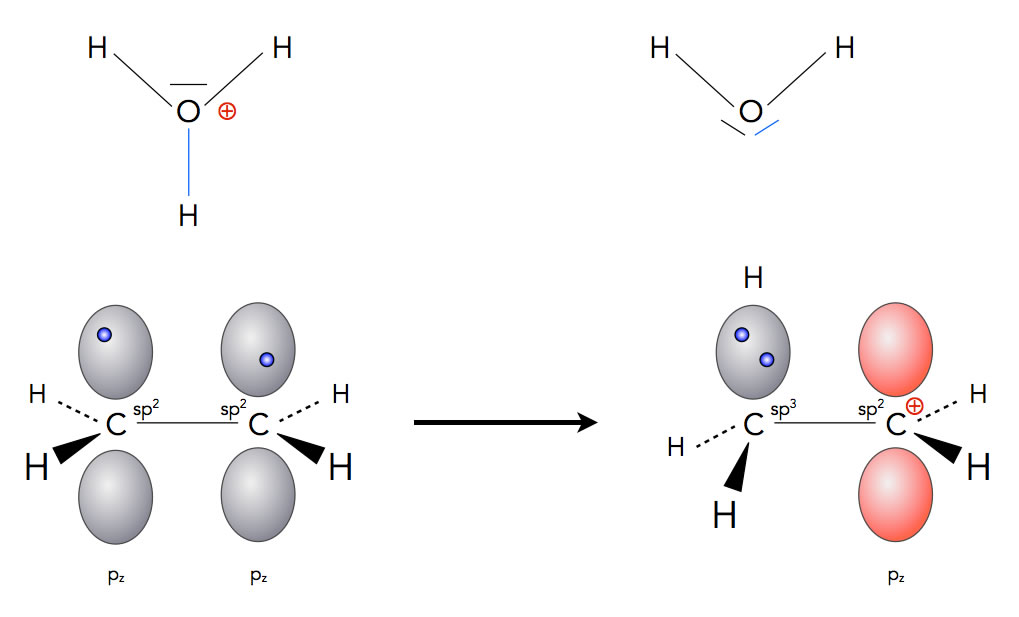
Der erste Schritt der Hydrobromierung in wässriger Lösung
Das abgespaltene Proton bildet dann eine kovalente Bindung mit einem der beiden C-Atome der Doppelbindung aus, und das andere C-Atom wird zum Carbenium-Ion, das dann ein Bromid-Anion anlagern kann. So entsteht ein Monobromalkan aus dem Alken. Im Prinzip verläuft die Reaktion so wie in der Gasphase, nur ist die Reaktionsgeschwindigkeit deutlich höher, da alle Ionen jetzt durch das polare Lösemittel stabilisiert werden.
Alkohol als Nebenprodukt
In einer wässrigen Lösung sind auch immer Hydroxid-Ionen anwesend. Diese können sich an das positive C-Atom des Carbenium-Ions anlagern. Dann entsteht ein Alkohol als Nebenprodukt. Auch bei anderen protischen Lösemitteln kann dies passieren.
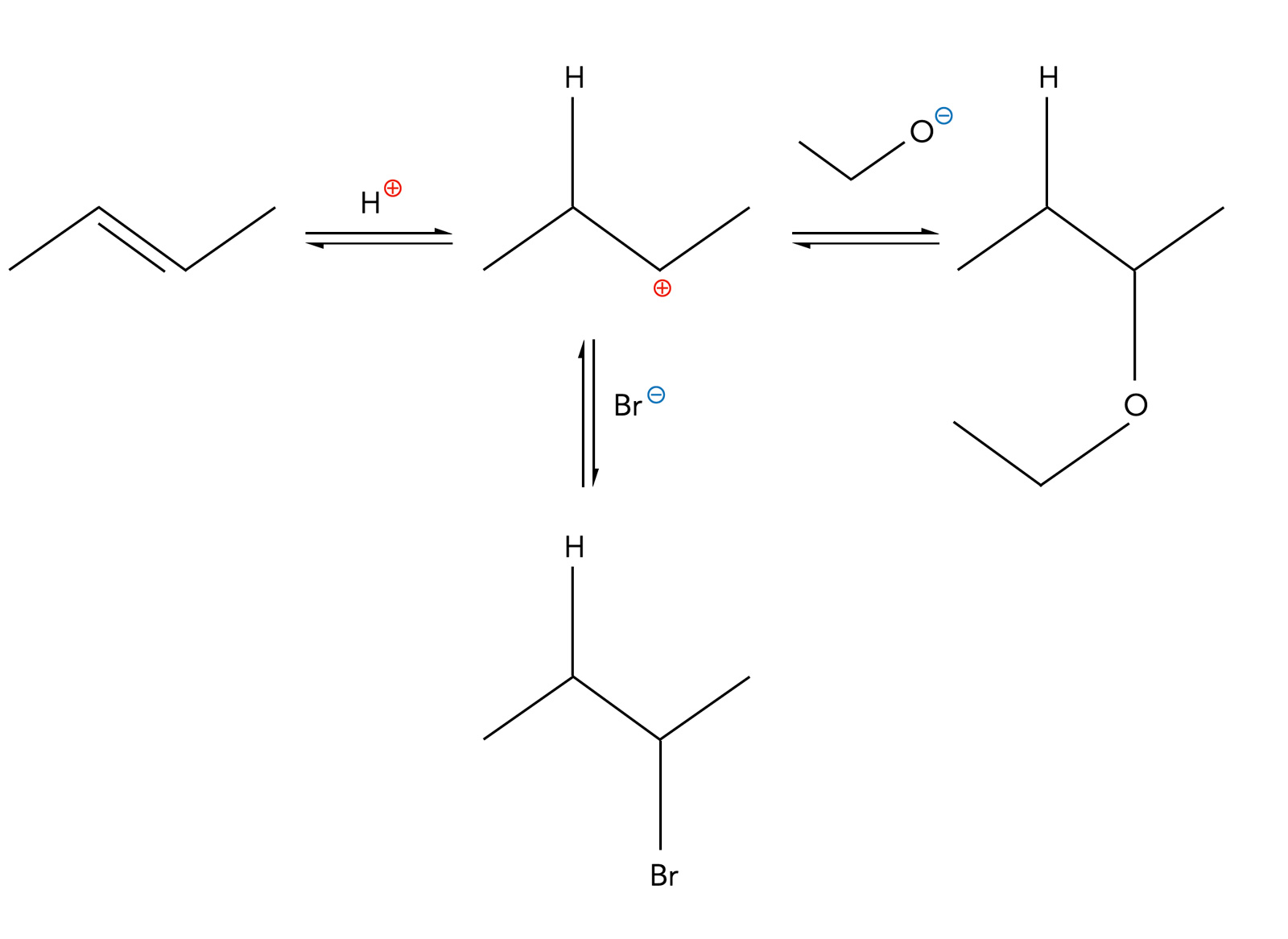
Etherbildung als Nebenreaktion der Hydrobromierung
Autor: Ulrich Helmich 02/2023, Lizenz: Public domain
Lässt man die Reaktion beispielsweise in Ethanol als Lösemittel ablaufen, können negativ geladene Ethanolat-Ionen CH3-CH2-O- das Carbenium-Ion angreifen, und ein Ether entsteht als Nebenprodukt.
Die Markownikow-Regel
Der russische Forscher Wladimir W. Markownikow entdeckte 1869, dass sich bei der Addition von Halogenwasserstoffen an Alkene das H-Atom immer an dasjenige C-Atom setzt, das bereits mit den meisten H-Atomen verbunden ist. Hier ein klassisches Beispiel:
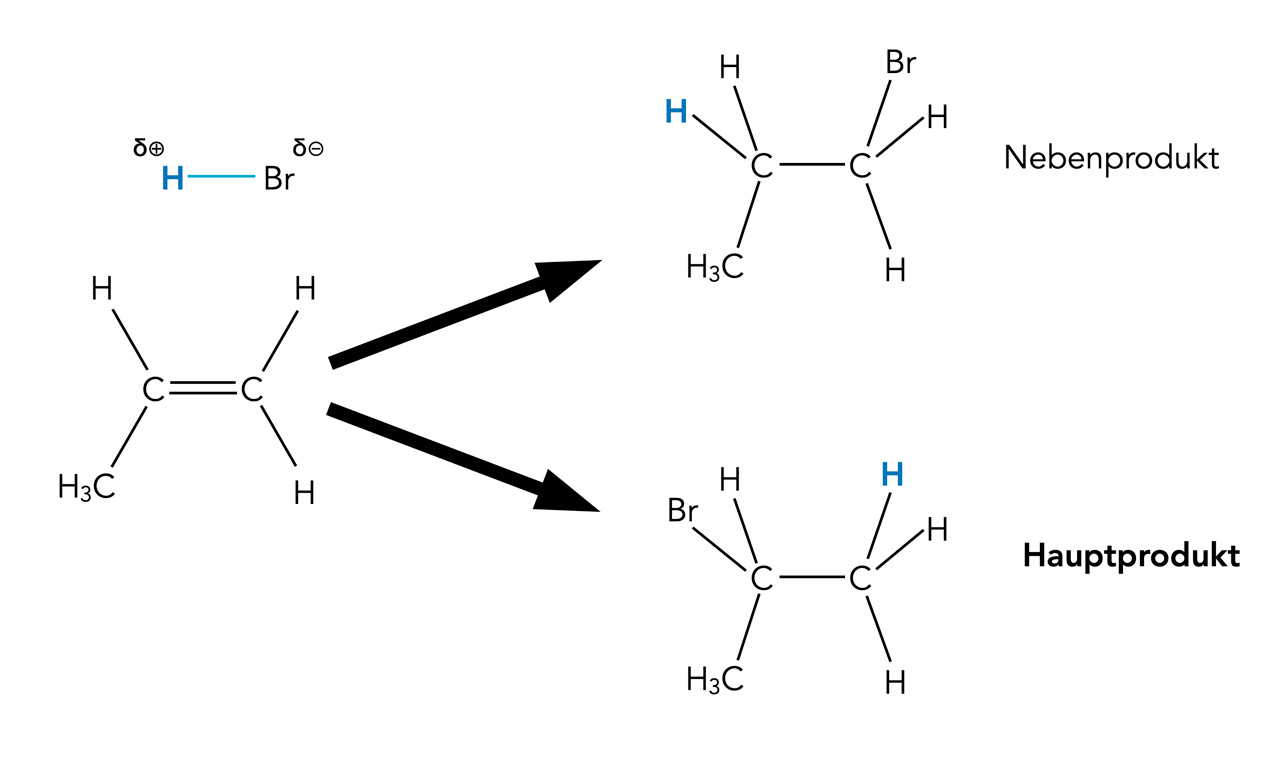
Addition von Bromwasserstoff an Propen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das rechte C-Atom des Propen-Moleküls in der Abbildung besitzt zwei H-Atome, das linke C-Atom nur eins. Der Wasserstoff des HBr-Moleküls setzt sich daher an das rechte C-Atom und nur im Ausnahmefall an das linke.
Heute weiß man, dass diese frühe Markownikow-Regel auf die unterschiedliche Stabilität von Carbenium-Ionen zurückzuführen ist. Das Proton des Halogenwasserstoff-Moleküls setzt sich so an die C=C-Doppelbindung, dass immer das jeweils stabilste Carbenium-Ion entsteht:
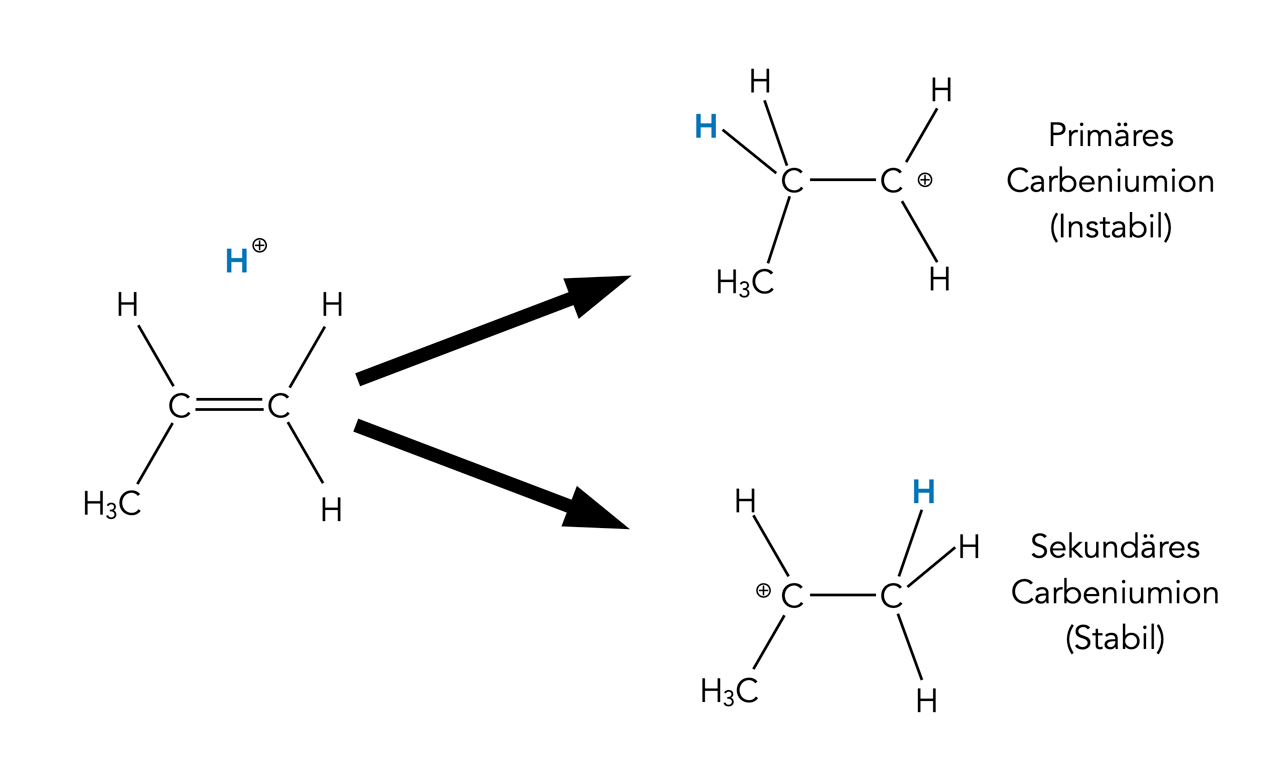
Sekundäre Carbenium-Ionen sind stabiler als primäre
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Auf dieser Lexikon-Seite finden Sie weitere Einzelheiten zur Markownikow-Regel und auch Hinweise zur Schreibweise des Namens.
Allerdings gibt es auch einige Ausnahmen von dieser Markownikow-Regel. Schauen wir uns dazu folgendes Beispiel an [2]:
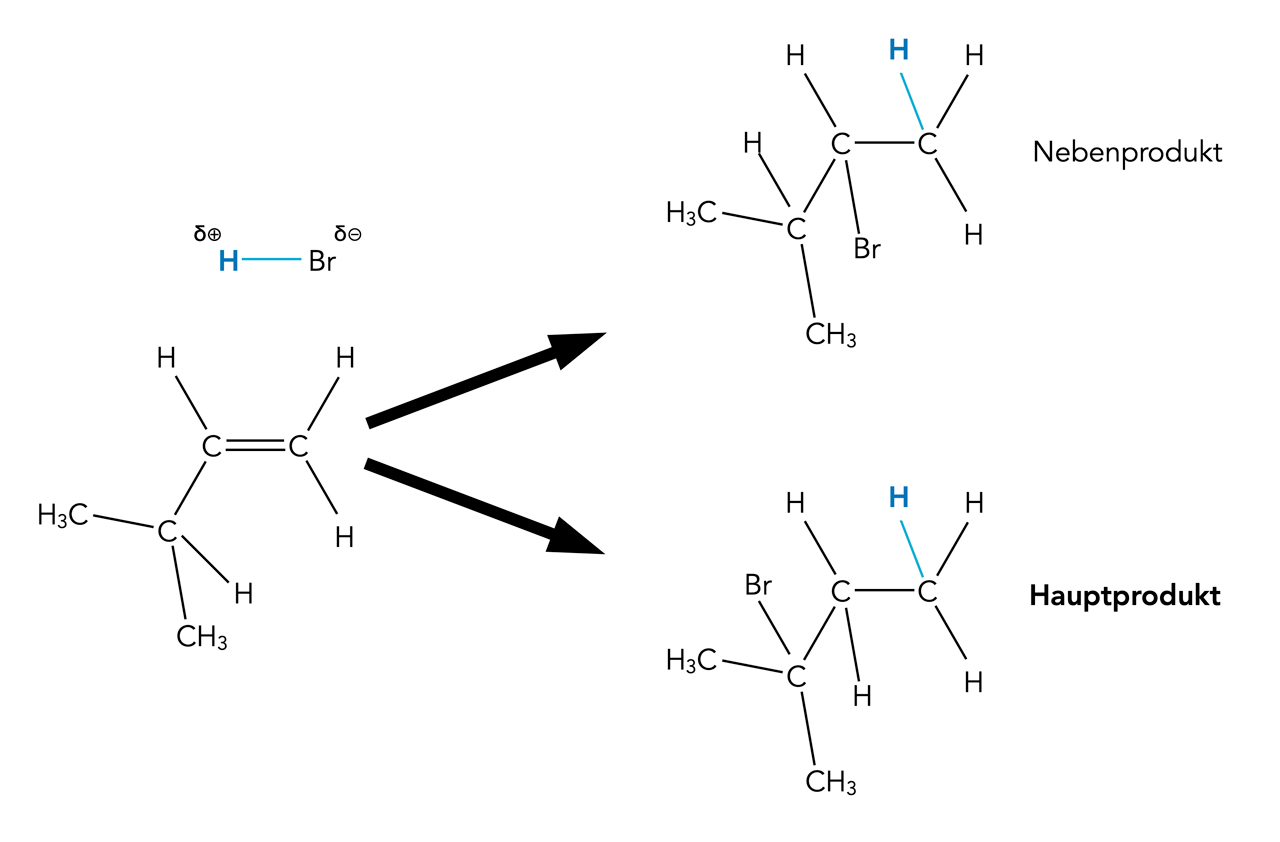
Hydrobromierung von 3-Methyl-but-1-en
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der Hydrobromierung von 3-Methyl-but-1-en sollte man das 2-Brom-3-Methyl-butan als Hauptprodukt erwarten und das 1-Brom-3-Methyl-butan als so gut wie nicht produziertes Nebenprodukt. Zumindest nach der Markownikow-Regel.
Was findet man aber? Ein völlig unerwartetes Hauptprodukt, nämlich 2-Brom-2-Methyl-butan. Wie konnte das geschehen? Die Antwort findet sich auf dem nächsten Bild:
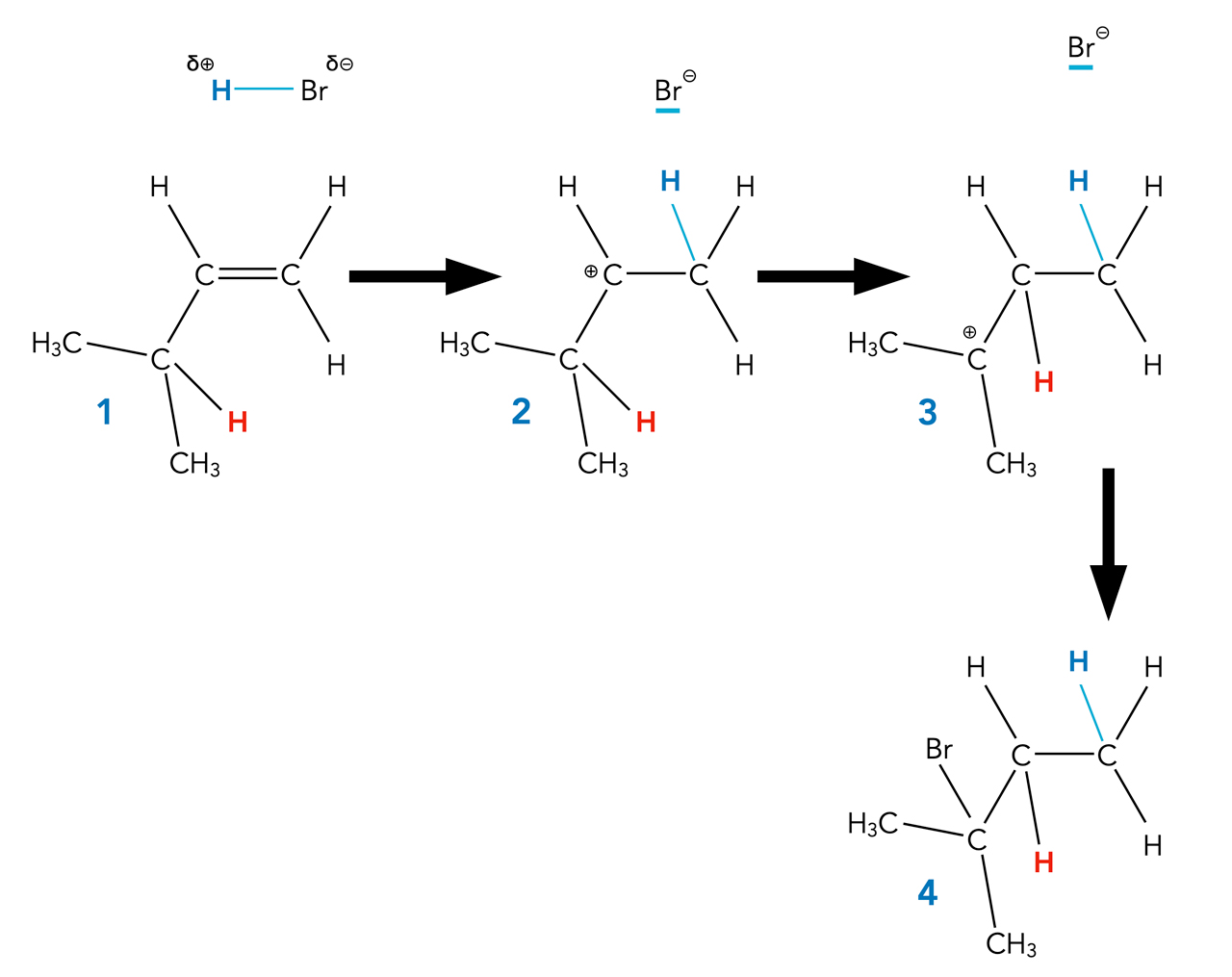
Carbenium-Ionen können sich umlagern
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Sitzt man auf einem Sofa und hat einen unbequemen Platz erwischt, setzt man sich bei der ersten Gelegenheit auf einen bequemeren Platz. Ein sekundäres Carbenium-Ion (2), das die Möglichkeit hat, zu einem tertiären und damit stabilerem Carbenium-Ion zu werden, nutzt diese Möglichkeit, wenn es eben geht.
Dazu muss allerdings ein H-Atom bewegt werden, von einem C-Atom zu einem benachbarten. Einen solchen Reaktionsschritt bezeichnet man in der Chemie als Umlagerung. Das in (2) rot gezeichnete H-Atom "wandert" zu dem positiven C-Atom, die positive Ladung "wandert" dann zu dem benachbarten C-Atom (3), wo sie durch stärkere +I-Effekte stabilisiert wird als in (2).
Bei der Reaktion entsteht also nicht das Markownikow-Produkt (also das nach der Markownikow-Regel erwartete Produkt), sondern ein abweichendes Produkt.
Anti-Markownikow-Additionen
Es gibt auch Additionsreaktionen an Alkene, bei denen die Markownikow-Regel verletzt wird. Das kann sterische Gründe haben, oder aber die Reaktion läuft nicht nach einem elektrophilen (ionischen) Mechanismus ab, sondern nach einem radikalischen.
Auf der Seite über die Radikalische Addition erfahren Sie einige Einzelheiten über diesen Reaktionsmechanismus und warum er zu Anti-Markownikow-Produkten führt.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.