Esterbildung als typisches Beispiel
In meinem eigenen Unterricht führe ich zum Einstieg in das Thema "Chemisches Gleichgewicht" immer folgenden Versuch durch: Die quantitative Synthese von Essigsäure-ethylester bzw. Ethylethanoat.
Versuch
Herstellung von Essigsäure-ethylester
Durchführung
In einem 250ml-Zweihalskolben werden folgende Stoffe gemischt:
- 30 ml konz. Essigsäure
- 58 ml Ethanol
- 50 ml Schwefelsäure der Konzentration 1 mol/l
Der Zweihalskolben wird dann in eine Heizhaube gestellt. Auf den großen Hals des Kolbens kommt ein Rückflusskühler, der kleine Hals wird mit einem Stopfen oder mit einem Thermometer verschlossen. Dann wird die Heizhaube eingeschaltet.
Direkt nach dem Einschalten der Heizhaube entnimmt man mit einer Pipette genau 2 ml des Stoffgemisches, verdünnt die Probe mit 10 bis 20 ml Wasser und bestimmt dann die Stoffmenge der in der Probe enthaltenen Säure1). Dies geschieht durch Titration mit 1-molarer Natronlauge und Phenolphthalein als Indikator2).
Wenn das Stoffgemisch siedet, wird eine zweite Probe von exakt 2 ml entnommen und wieder mit NaOH titriert. Weitere Proben werden 15, 30 und 45 Minuten nach Siedebeginn entnommen und titriert.
1) Siehe hierzu "Kleines Problem" im Folgetext
2) Bei der Titration mit NaOH entsteht Natriumacetat, ein basisches Salz, dessen Äquivalenzpunkt zwischen pH 8 und pH 8,5 liegt. Universalindikator schlägt aber schon bei pH 7 um. Bei pH 7 ist die Neutralisation jedoch noch nicht beendet, man benötigt einen Indikator, dessen Umschlagpunkt ungefähr dem Äquivalenzpunkt von Natriumacetat entspricht, ein guter Kandidat hierfür ist Phenolphthalein oder auch Thymolphthalein.
Kleines Problem
Bei der Bestimmung der Säurekonzentration in den entnommenen Proben gibt es ein kleines Problem: Das Stoffgemisch enthält nicht nur das Edukt Essigsäure, sondern auch den Katalysator Schwefelsäure. Beide Säuren, die Essigsäure und die Schwefelsäure, reagieren jetzt mit der Natronlauge. Der Sinn der Titration ist es aber, die Konzentration der Essigsäure während des Versuchsablaufs zu verfolgen.
Problemlösung
Wir stellen eine Kontroll-Lösung her, die folgendermaßen zusammengesetzt ist:
- 88 ml dest. Wasser
- 50 ml Schwefelsäure der Konzentration 1 mol/l
Von dieser Kontroll-Lösung werden dann ebenfalls genau 2 ml titriert. Wenn man jetzt zum Beispiel 2,1 ml NaOH verbraucht, weiß man, dass man bei jeder der folgenden Titrationen 2,1 ml vom Ergebnis V(NaOH) abziehen muss, um die Konzentration der noch nicht umgesetzten Essigsäure zu berechnen.
Das Versuchsergebnis
Hier die Ergebnisse einer Schülergruppe, die den Versuch im März 2016 durchgeführt hat, allerdings mit den Stoffmengen, wie sie im Schroedel-Band "Chemie heute SII Einführungsphase" von 2014 angegeben sind: 15g Essigsäure, 23g Ethanol und 25ml Schwefelsäure (c = 1 mol/l).
| Zeitpunkt der Probenentnahme | Verbrauch an NaOH in ml |
| t = Start | 10,0 |
| t = Siedebeginn | 9,0 |
| t = 15 min | 5,0 |
| t = 30 min | 4,5 |
| t = 45 min | 4,0 |
Zur Titration der Kontroll-Lösung benötigte die Gruppe 1,5 ml Natronlauge; die korrigierten Ergebnisse sehen also so aus:
| Zeitpunkt der Probenentnahme | Verbrauch an NaOH in ml | Stoffmenge n(NaOH) = n(HAC) in mol |
Konzentration c(HAc) in mol/l |
| t = Start | 8,5 | 0,0085 | 4,25 |
| t = Siedebeginn | 7,5 | 0,0075 | 3,75 |
| t = 15 min | 3,5 | 0,0035 | 1,75 |
| t = 30 min | 3 | 0,0030 | 1,5 |
| t = 45 min | 2,5 | 0,0025 | 1,25 |
Auswertung
Stellen wir die Versuchsergebnisse nun graphisch dar:
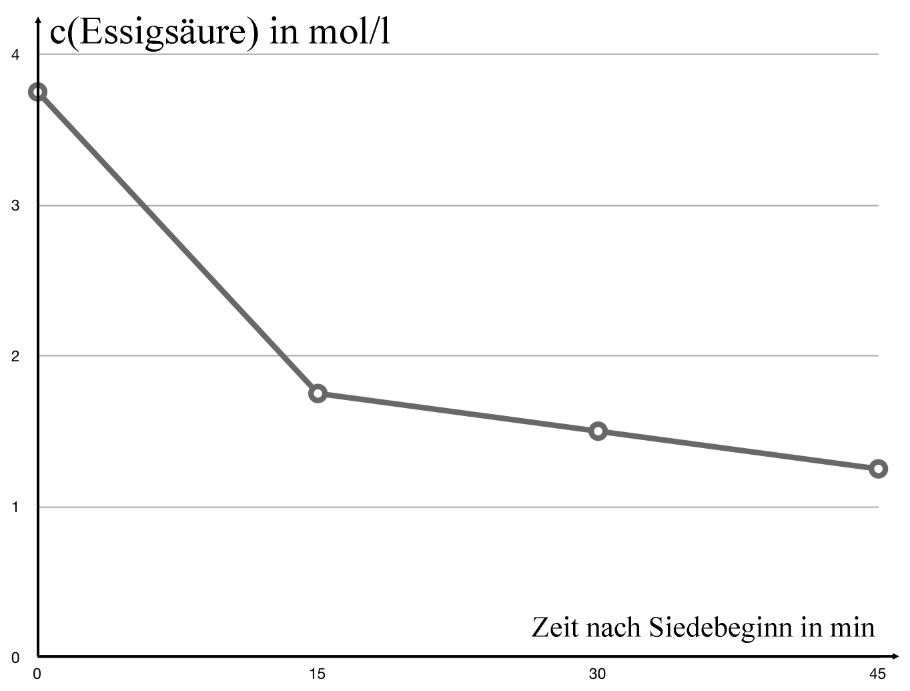
Graphische Darstellung der Abnahme der Essigsäurekonzentration
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Dann sehen wir, dass die Essigsäurekonzentration in den ersten Minuten sehr schnell, dann aber deutlich langsamer abnimmt. Leider hatten wir in der Schule nicht so viel Zeit für den Versuch wie Pean De Saint-Gilles und Marcellin Berthelot im Jahre 1860. Diese beiden Forscher haben den Versuch nämlich über ein ganzes Jahr beobachtet - allerdings ohne Katalysator Schwefelsäure. Mit Schwefelsäure dauert der Versuch "nur" 4 bis 7 Tage, je nach zugesetzter Menge an Schwefelsäure. Hier die Ergebnisse aus dem Jahre 1860:
| Zeitpunkt der Probenentnahme | Anteil der verbrauchten Essigsäure |
| 15 Tage | 10% |
| 20 Tage | 14% |
| 70 Tage | 37,8% |
| 128 Tage | 46,8% |
| 154 Tage | 48,1% |
| 277 Tage | 53,7% |
| 368 Tage | 55% |
Schauen wir uns die graphische Darstellung dieser Ergebnisse an. Allerdings habe ich hier nicht den Anteil der verbrauchten Essigsäure zu Grunde gelegt, sondern den Anteil der noch unverbrauchten Essigsäure. So kann man diese Abbildung besser mit den Ergebnissen aus meinem Unterricht vergleichen.
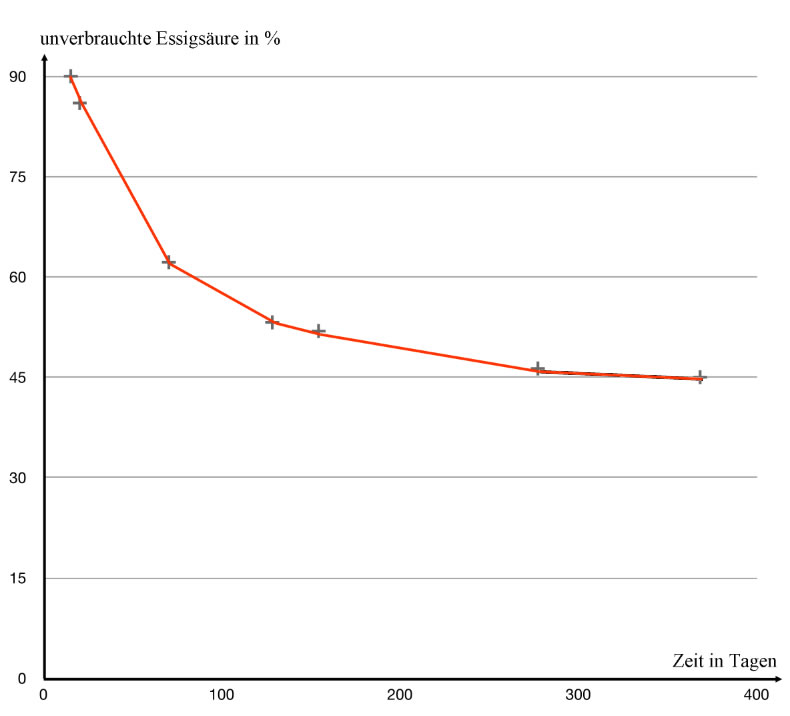
Darstellung der Versuchsergebnisse von 1860
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Die Abbildung 2 zeigt, dass nie der Zeitpunkt erreicht wird, an dem die Essigsäure komplett verbraucht ist. Nach 400 Tagen konnten die beiden französischen Forscher aber keine Veränderung der Essigsäurekonzentration mehr beobachten. Die Reaktion hatte eine Art Gleichgewichtszustand erreicht.
Esterhydrolyse
Wenn ich mal viel Zeit habe (aber wann hat man das schon), mache in im Unterricht auch den Gegenversuch zur Estersynthese, die Esterhydrolyse. Eine genaue Versuchsanleitung spare ich mir hier. Im bereits oben kurz erwähnten Schroedel-Band findet sich aber eine schöne Anleitung für diesen Versuch.
Bei der Esterhydrolyse geht man von Essigsäure-ethylester aus, gibt eine stöchiometrische Menge Wasser sowie Schwefelsäure als Katalysator hinzu und entnimmt wieder alle 15 Minuten kleine Proben der Versuchslösung, um durch Titration mit NaOH die Konzentration der gebildeten Essigsäure zu berechnen.
Am Anfang verläuft die Esterhydrolyse recht schnell, mit der Zeit wird die Reaktion aber immer langsamer, bis sich nach vier bis sieben Tagen nichts mehr an der Essigsäurekonzentration ändert.
Und nun kommt das Überraschende und Interessante: Nach vier bis sieben Tagen (je nach Menge des Katalysators) hat man die gleiche Essigsäurekonzentration erreicht wie bei der Synthese des Esters nach vier bis sieben Tagen. Dieses Phänomen möchte ich mal durch eine simple Zeichnung veranschaulichen:
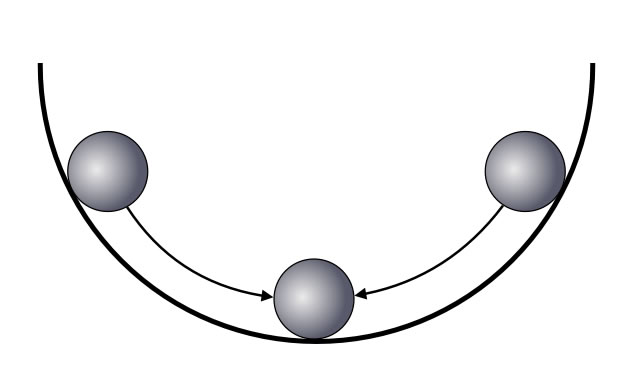
Schüsselbeispiel: Statisches Gleichgewicht am Beispiel einer Kugel in einer Schüssel
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Stellen Sie sich vor, eine Kugel befindet sich in einer runden Schüssel. Dann ist es völlig egal, ob man die Kugel an den linken Rand der Schüssel hält und dann loslässt oder ob man die Kugel an den rechten Rand der Schüssel hält und dann loslässt. Die Kugel landet stets in der Mitte der Schüssel, an der tiefsten Stelle.
Übertragen wir dieses einfache Beispiel auf die Bildung des Esters:
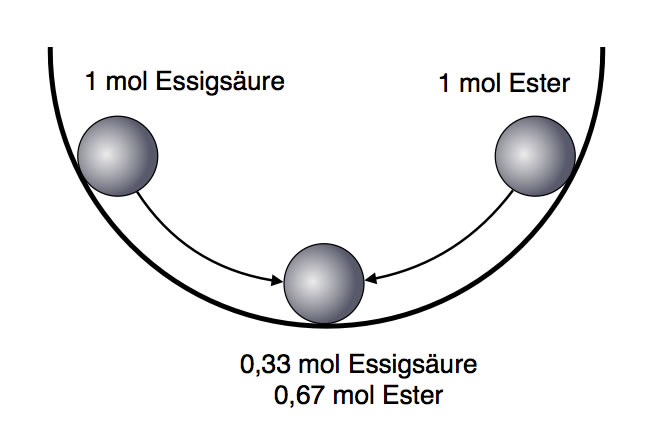
Übertragung auf das chemische Gleichgewicht bei der Veresterung bzw. Esterhydrolyse
Autor: Ulrich Helmich 2016, Lizenz: Public domain.
Wenn man 1 mol Essigsäure mit 1 mol Ethanol bei Zimmertemperatur reagieren lässt, erhält man nach einigen Tagen stets 0,67 mol Essigsäure-ethylester und 0,67 mol Wasser. 0,33 mol Essigsäure bleiben übrig, sie reagieren nicht.
Lässt man umgekehrt 1 mol Essigsäure-ethylester mit 1 mol Wasser bei Zimmertemperatur reagieren, bekommt man nach einigen Tagen ebenfalls 0,33 mol Essigsäure, während 0,67 mol Essigsäure-ethylester nicht reagieren.
Es stellt sich also immer der gleiche Gleichgewichtszustand ein.
Ein paar Fragen für kritische Schüler
Bevor wir nun mit dem eigentlichen Thema "chemisches Gleichgewicht" weitermachen, habe ich ein paar kritische Fragen, die wir hier gemeinsam beantworten wollen.
Ein paar Fragen zur Versuchsdurchführung und -auswertung
Bei der Versuchsdurchführung stellt sich die Frage, wieso man die 2 ml-Proben, die man mit der Pipette sorgfältig entnimmt, mit einer fast beliebigen Menge Wasser vermischen kann.
- Antwort: Durch das Verdünnen mit dem Wasser ändert sich die Stoffmenge n(Essigsäure) in der Probe nicht. Die Natronlauge reagiert beim Titrieren nur mit der Essigsäure und der Schwefelsäure, nicht jedoch mit dem Wasser. Das Verdünnen geschieht lediglich aus praktischen Gründen, weil man 2 ml Flüssigkeit selbst in einem kleinen 50 ml-Becherglas so gut wie nicht sieht.
Die nächste Frage, die sich bei der Auswertung der Versuchsergebnisse stellt, ist die: Wieso wurde in der graphischen Darstellung der Ergebnisse nicht die Probenentnahme direkt nach Versuchsbeginn berücksichtigt. Der Graph startet mit dem Siedebeginn, wieso?
- Antwort: Die Geschwindigkeit einer chemischen Reaktion steigt mit der Temperatur (RGT-Regel). Es macht wenig Sinn, Messungen zum chemischen Gleichgewicht durchzuführen, wenn sich ständig die Temperatur ändert. Sobald das Stoffgemisch jedoch siedet, ändert sich die Temperatur nicht mehr, kann also als konstante Größe angesehen werden. Erst dann machen die Probenentnahmen eigentlich Sinn.
Und noch eine Frage zum Schüsselbeispiel
Das Schüsselbeispiel (Abb. 3 und 4) zur Einstellung des chemischen Gleichgewichts ist eigentlich sehr anschaulich, hat aber doch einen Nachteil bzw. eine Schwachstelle. Können Sie sagen, wo hier die Schwachstelle liegt?
- Antwort: Wenn man eine Kugel in eine Schüssel fallen lässt, stellt sich ein statisches Gleichgewicht ein. Die Kugel bliebt an der tiefsten Stelle liegen. Das Gleichgewicht, das sich bei der Reaktion von Essigsäure mit Ethanol einstellt, ist aber kein statisches Gleichgewicht, sondern ein dynamisches.
Auch wenn sich für den außenstehenden Betrachter - die Schülerin, die die Proben entnimmt - nach vier bis sieben Tagen nichts mehr an der Konzentration der Essigsäure ändert, findet dennoch eine Reaktion statt. Auch nach der Einstellung des chemischen Gleichgewichts reagieren Essigsäure-Moleküle mit Ethanol-Molekülen zu Ester- und Wasser-Molekülen.
Gleichzeitig reagieren aber auch Ester- und Wasser-Moleküle miteinander wieder zu Essigsäure- und Ethanol-Molekülen zurück.
Es tut sich also ständig etwas in dem Reaktionsgemisch, nur merkt das keiner, weil sich die Konzentrationen der Stoffe nicht mehr verändern.
Seitenanfang
Weiter mit
dem Massenwirkungsgesetz...