Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- Was man unter der Reaktionsgeschwindigkeit vR einer chemischen Reaktion versteht,
- wie man die Reaktionsgeschwindigkeit vRim Prinzip messen kann,
- was der Unterschied zwischen volumetrischer und gravimetrischer Messung ist,
- wie man eine volumetrische Messung graphisch auswertet,
- welche weiteren Messmethoden der Reaktionsgeschwindigkeit vR es noch gibt.
Auf der letzten Seite hatten wir festgestellt, dass die Geschwindigkeit einer chemischen Reaktion von drei wichtigen Faktoren beeinflusst wird: Der Konzentration der Edukte, dem Zerteilungsgrad der Edukte und der Temperatur. Je höher die Eduktkonzentration, je größer der Zerteilungsgrad, und je höher die Temperatur, desto höher die Reaktionsgeschwindigkeit.
Auf dieser Seite wollen wir uns mit der Frage beschäftigen, wie man die Reaktionsgeschwindigkeit genau messen kann. Für die Schulchemie spielen dabei vor allem zwei Verfahren eine wichtige Rolle, die volumetrische Messung und die gravimetrische Messung.
Volumetrische Messung der Reaktionsgeschwindigkeit
Bei der Reaktion von Zink oder Magnesium mit Salzsäure hatten wir gesehen, dass die Reaktionsgeschwindigkeit mit der Konzentration der Salzsäure steigt. Bei einer doppelt konzentrierten Salzsäure sollte die Reaktion ungefähr auch doppelt so schnell ablaufen. Doch stimmt das auch? Um diese Frage zu überprüfen, muss man die Reaktionsgeschwindigkeit quantitativ messen, also in genauen Zahlen ausdrückbar.
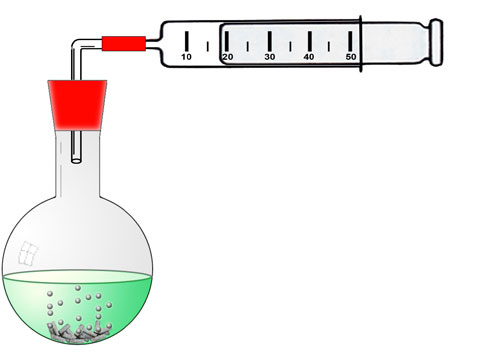
Die Methode der volumetrischen Messung basiert darauf, dass man das Volumen eines bei der Reaktion entstehenden Gases misst. Bei der Reaktion zwischen Salzsäure und Zink oder Magnesium entsteht das Gas Wasserstoff. Mit einem Kolbenprober kann man das während der Reaktion entstehende Wasserstoff-Volumen genau messen. Betrachten Sie dazu die folgende Abbildung:
Der entstehende Wasserstoff drückt den Kolben des Kolbenprobers nach außen, und mithilfe der Skala kann man genau ablesen, wie viele ml H2-Gas zu einem gegebenem Zeitpunkt insgesamt gebildet worden sind.
Praktische Hinweise zum Kolbenprober
Der verwendete Kolbenprober muss sehr leichtgängig sein, damit der entweichende Wasserstoff den Kolben nach außen drücken kann. Wenn man den Kolbenprober mit der Hand senkrecht nach unten hält, muss der Kolben ruckelfrei aus dem Kolbenprober herausgleiten. Mit der anderen Hand fängt man ihn dann auf.
Der Kolben darf aber andererseits auch nicht zu locker in dem Kolbenprober sitzen. Baut man den Versuch wie in der Abbildung auf - mit herausgezogenem Kolben - dann darf man den Kolben nicht einfach in den Kolbenprober hineindrücken können. Wenn dies gelingt, sitzt der Kolben zu locker. Bei dem Versuch könnte dann Wasserstoff am Kolben vorbei nach außen entweichen, und man würde nur einen Teil des gebildeten Gasvolumens messen.
Bei der Durchführung des eigentlichen Versuchs muss der Kolben natürlich ganz in den Kolben hineingeschoben sein.
Bei diesem Versuch kann es passieren, dass man zu viel Salzsäure verwendet. Die Reaktion verläuft dann sehr schnell, der Kolbenprober ist innerhalb weniger Sekunden vollständig mit Gas gefüllt. Natürlich können die Schüler(innen) den Kolbenprober mit ihrem Smartphone filmen und dann das Video Sekunde für Sekunde analysieren.
Praktische Hinweise zur Ermittlung der maximalen HCl-Menge
für einen 100 ml-Kolbenprober
Vergegenwärtigen wir uns noch einmal die Reaktionsgleichung:
$Zn (s) + 2 \ HCl (aq) \to ZnCl_{2} (aq) + H_{2} (g)$
Um ein Wasserstoff-Molekül zu produzieren, sind zwei Salzsäure-Moleküle notwendig. Angenommen, ein Kolbenprober fasst ein Volumen von 100 ml. Wasserstoff hat bei Raumtemperatur ein molares Volumen zwischen 22,4135 Litern[1] und 22,2469 Litern[2]. Der Mittelwert zwischen diesen beiden Angaben liegt irgendwo bei 22,3 Litern, und damit rechnen wir einfach mal weiter.
1 mmol des Gases hat also ein Volumen von 22,3 ml, und wenn wir die 100 ml des Kolbenprobers durch diesen Wert dividieren, erhalten wir 4,48 mmol Wasserstoff. Um diese 4,48 mmol H2 zu erzeugen, werden 8,96 mmol HCl benötigt. Wenn wir eine 1-molare Salzsäure verwenden, ist diese Stoffmenge in genau 8,96 ml HCl enthalten. Da wahrscheinlich kein Schüler das so genau abmessen kann und wahrscheinlich auch keine Schülerin, verwenden wir genau 9 ml. Sollten es dann 10 ml sein, ist das auch nicht schlimm.
Das Zink bzw. Magnesium müssen wir bei dem Versuch nicht abwiegen, solange ein deutlicher Überschuss vorliegt.
Ich habe im Mai 2011 den Versuch gefilmt und konnte so die Zunahme des Wasserstoff-Volumens im Kolbenprober detailliert aufzeichnen.
Hier zwei dieser Filme mit 0,25-molarer und 1,0-molarer Salzsäure und Magnesium (im Überschuss):
HCl der Konzentration c(HCl) = 0,25 mol/l und Magnesium:
HCl der Konzentration c(HCl) = 1,0 mol/l und Magnesium:
Der fertige Film wurde dann genau analysiert; jede volle Sekunde wurden die Messwerte abgelesen und in eine Tabellenkalkulation (Excel) eingegeben. Hier die graphische Darstellung der Messwerte:
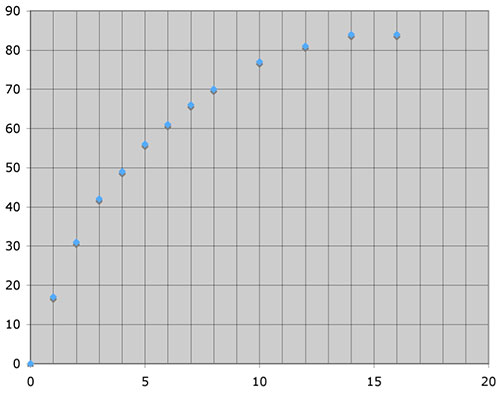
y-Achse: Wasserstoff-Volumen V(H2) in ml
x-Achse: Zeit in Sekunden
Man kann sehr schön eine Sättigungskurve erkennen; mit der Zeit entsteht pro Sekunde immer weniger Wasserstoff.
Alternativ - so habe ich das beim letzten Mal auch gemacht - spielt man den Film mit Quicktime ab und stoppt jedes Mal, wenn eine bestimmte Marke erreicht wurde, zum Beispiel bei 10, 20, 30, 40 und 50 ml Wasserstoff-Volumen. Dann liest man die Zahl der Frames (Bilder) ab, die bis dahin vergangen sind. Das ist wesentlich genauer als die Zahl der Sekunden abzulesen, im Prinzip sogar 24 mal genauer, falls der Film mit 24 Bildern pro Sekunde abläuft.
Wir wollen nun die Reaktionsgeschwindigkeit in Abhängigkeit von der Zeit graphisch darstellen. Dazu berechnen wir für jeden Zeitabschnitt, wie viel Wasserstoff produziert wurde und nennen diese Differenz ΔV(H2).
Beispiel:
Zur Zeit t=0 wurde noch kein Wasserstoff produziert, zur Zeit t=1 (Sekunde) hatten wir ein Wasserstoffvolumen V(H2) von 17 ml im Kolbenprober. Also ist ΔV(H2) = V(H2)1 - V(H2)0 = 17 - 0 = 17 ml.
Zur Zeit t=2 waren bereits 31 ml Wasserstoff im Kolbenprober. Die Differenz berechnet sich jetzt folgendermaßen: ΔV(H2) = V(H2)2 - V(H2)1 = 31 - 17 = 14 ml.
Stellt man nun diese Differenzen ΔV(H2) in Abhängigkeit von der Zeit dar, so erhält man folgende Graphik:
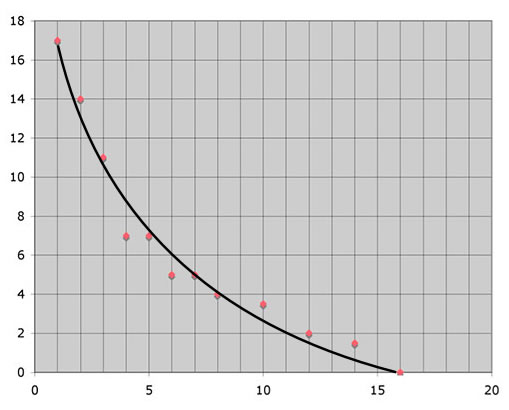
y-Achse: Differenz ΔV(H2) = V(H2)t - V(H2)t-1 in ml
x-Achse: Zeit in Sekunden
Diese Graphik zeigt, dass am Anfang pro Sekunde sehr viel Wasserstoff entsteht, mit der Zeit wird die Wasserstoffproduktion pro Zeiteinheit aber immer geringer. Die Kurve zeigt nichts anderes als die Abnahme der Reaktionsgeschwindigkeit. Man könnte also tatsächlich das Wort "Reaktionsgeschwindigkeit" an die y-Achse schreiben.
Nach 16 Sekunden ist die Reaktion in diesem Beispiel beendet.
Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit vR ist ein Maß für die pro Zeiteinheit (Minute oder Sekunde) entstehende Stoffmenge eines Reaktionsprodukts.
Wie man leicht sieht, nimmt die Geschwindigkeit der Reaktion immer mehr ab, sie nähert sich am Ende dem Wert Null. Das ist ja auch logisch: Von der Salzsäure wird im Laufe der Reaktion immer mehr verbraucht, bis schließlich nichts mehr da ist. Und wenn keine HCl mehr im Erlenmeyerkolben vorhanden ist, kann auch kein Wasserstoff entstehen - die Reaktionsgeschwindigkeit der H2-Bildung ist dann Null.
Gravimetrische Messung der Reaktionsgeschwindigkeit
Eine völlig andere Methode zur Messung der Reaktionsgeschwindigkeit nutzt die Tatsache aus, dass das bei der Reaktion entweichende Gas eine bestimmte Masse hat. Reaktionen, bei denen Wasserstoff freigesetzt wird, sind für dieses Verfahren nicht so gut geeignet, weil Wasserstoffgas eine sehr geringe Masse hat (nur 2 g/mol). Dieses Verfahren eignet sich für Reaktionen, bei denen Kohlendioxid freigesetzt wird. CO2 hat mit 44 g/mol eine deutlich höhere Masse.
Durchführung
Für eine Reaktion, bei der Wasserstoff freigesetzt wird, braucht man eine sehr empfindliche Waage, für Kohlendioxid produzierende Reaktionen reicht eine normale Schülerwaage, die auf 0,1 g genau wiegt. Bei diesem Versuch soll die Reaktion von Salzsäure (oder Essigsäure) mit Calciumcarbonat untersucht werden.
Man stellt den Erlenmeyerkolben (am besten weithalsig, damit das Gas besser entweichen kann) oder das Becherglas (noch besser) auf die Waage, gibt die genau abgemessene Säure in das Gefäß und stellt die Waage auf Null (Tarier-Funktion). Das Calciumcarbonat (im Überschuss!) gibt man dann möglichst zügig in die Säure und filmt die Anzeige der Waage. Nach Abschluss der Reaktion wird das Video ausgewertet.
Auswertung
Wenn der Versuch wie geplant abläuft, sollte das Display der Waage immer weniger Gewicht bzw. Masse anzeigen. Der Massenrückgang sollte zu Beginn der Reaktion pro Sekunde sehr groß sein und im Laufe der Reaktion immer geringer werden.
Aus dem Gewichtsverlust kann dann die Masse des pro Sekunde entstandenen Kohlendioxids berechnet werden, und daraus wiederum die Stoffmenge der noch im Kolben vorhandenen Salzsäure. Aus n(HCl) kann dann c(HCl) in Abhängigkeit von der Zeit berechnet und graphisch dargestellt werden.
Weitere Methoden zur Messung der Reaktionsgeschwindigkeit
Neben der volumetrischen und der gravimetrischen Methode gibt es weitere Methoden zur Messung der Reaktionsgeschwindigkeit.
Methoden für Reaktionen, bei denen Farbstoffe entstehen
Entsteht bei der chemischen Reaktion ein Farbstoff als Produkt, so kann man die Konzentration dieses Farbstoffs mit einem Photometer messen. Dabei handelt es sich im Prinzip um ein Gerät, das feststelle, wie viel Licht durch eine Probe des Farbstoffs "durchgeht". Ein solches Photometer besteht aus einer Lichtquelle, einem Probenbehälter und einem Photosensor. Ist die Farbstoffkonzentration im Probenbehälter hoch, wird nur ein geringer Bruchteil des Lichtes durchgelassen. Ist die Farbstoffkonzentration dagegen klein, wird viel Licht durchgelassen. Schließt man ein solches Photometer an einen automatischen Schreiber oder einen Computer an, so kann man die Veränderung der Farbstoffkonzentration während der Reaktion kontinuierlich aufzeichnen.
Eine interessante Variante dieses Verfahrens wird in einigen Schulbüchern wie beispielsweise "Chemie heute" vom Schroedel-Verlag genannt. Man gibt eine Thiosulfat-Lösung bekannter Konzentration mit 1-molarer Salzsäure zusammen, stellt den Erlenmeyerkolben auf ein Blatt weißes Papier, auf das man zuvor ein schwarzes Kreuz gezeichnet hat. Dann misst man die Zeit, die vergeht, bis man das Kreuz nicht mehr sehen kann, wenn man von oben in den Erlenmeyerkolben schaut. Je konzentrierter die Salzsäure bzw. die Thiosulfatlösung, desto schneller läuft die Reaktion ab.
Methoden für Reaktionen, bei denen Farbstoffe entfärbt werden
Ist ein Edukt der chemischen Reaktion ein Farbstoff und wird dieser Farbstoff während der Reaktion entfärbt, so kann man mit einem Photometer die abnehmende Konzentration des Edukts verfolgen.
Es geht hier aber auch einfacher. Man kann beispielsweise die Zeit stoppen, die bis zur völligen Entfärbung des Farbstoffs vergeht. Allerdings erhält man dann mit Sicherheit keine Momentangeschwindigkeit, sondern nur einen sehr groben Wert für die Durchschnittsgeschwindigkeit in dem Zeitintervall. Will man die Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit auf diese Weise ermitteln, so muss man mehrere Parallelversuche mit unterschiedlichen Ausgangskonzentrationen durchführen.
Methoden für Reaktionen, bei denen eine Säure / Lauge entsteht bzw. verbraucht wird
Entsteht bei der Reaktion eine Säure, so steigt die Protonenkonzentration während der Reaktion an. Im einfachsten Fall setzt man dem Reaktionsgemisch einen Universalindikator zu und verfolgt die Farbänderungen mit dem bloßen Auge, der Videokamera oder einem Photometer.
Sollte dies aus irgendeinem Grund nicht möglich sein, so kann man auch in bestimmten Zeitabständen kleine Proben des Reaktionsgemisches entnehmen und dann deren jeweiligen pH-Wert bestimmen, um Aufschluss über die gerade herrschende Protonenkonzentration zu bekommen. Bei diesem Verfahren gibt es allerdings ein Problem: In den Proben läuft die Reaktion weiter, wenn man nichts dagegen unternimmt (schnelles Abkühlen, Zugabe eines Inhibitors o. Ä.).
Wird bei der Reaktion eine Säure verbraucht, kann man auf die gleiche Weise verfahren. Das selbe gilt dann, wenn bei der Reaktion eine Lauge entsteht oder verbraucht wird.
Ein bekannter Schulversuch, bei dem dieses Verfahren angewandt wird, ist die Veresterung von Essigsäure mit Ethanol zu Essigsäure-ethylester. Die Reaktion verläuft sehr langsam, bis sich das chemische Gleichgewicht eingestellt hat, vergehen teilweise Stunden. Alle 10 oder 15 Minuten wird eine kleine Probe aus dem Reaktionskolben entnommen und dann mit 1 molarer NaOH titriert, um die Säurekonzentration in dem Reaktionskolben zur Zeit t zu bestimmen.
In meinem aktuellen Chemiekurs (Januar 2019) haben wir die Reaktion von Salzsäure mit Zink auf diese Weise untersucht. Das Verfahren mit der kontinuierlichen Messung des pH-Wertes (es wurde kein Indikator verwendet, sondern ein pH-Messgerät) lief sehr gut.
Methoden für Reaktionen, bei denen Ionen entstehen bzw. verbraucht werden
Entstehen bei der Reaktion Ionen oder werden Ionen verbraucht, so kann man eventuell über die Veränderung der elektrischen Leitfähigkeit die Konzentrationen der Edukte oder Produkte verfolgen. Dazu müssen allerdings die genauen Beiträge der einzelnen Ionensorten zur Gesamtleitfähigkeit der Lösung bekannt sein. Protonen haben beispielsweise eine sehr viel höhere Leitfähigkeit als Sulfat-Ionen, weil sie kleiner und beweglicher sind.
Methoden für Reaktionen mit optisch aktiven Substanzen
Viele organische Verbindungen, vor allem auch Zucker, drehen die Schwingungsebene von polarisiertem Licht. Mit Hilfe eines Polarimeters kann man den optischen Drehwinkel der Substanzen untersuchen. Historisch interessant ist diese Methode, weil bereits Ludwig Wilhelmy (1812-1864), ein deutscher Chemiker aus Heidelberg, um 1850 die ersten systematischen Untersuchungen zur Reaktionsgeschwindigkeit durchführte, die auch heutige Standards noch erfüllen würde.
Er untersuchte die saure Hydrolyse von Saccharose zu Fructose und Glucose. Kurz vorher hatte man entdeckt, dass Mono- und Disaccharide polarisiertes Licht spezifisch um einen bestimmten Winkel drehen können, was man mit einem Polarimeter gut messen kann. Bei der Hydrolyse von Saccharose ändert sich der Drehwinkel kontinuierlich, erst schnell, dann immer langsamer. Am Ende, wenn die Reaktion beendet ist, bleibt er konstant. Mit Hilfe dieser Technik konnte Wilhelmy die Stoffumsätze während des Ablaufs der Hydrolyse kontinuierlich verfolgen.
Quellen:
- internetchemie.info/chemie-lexikon/daten/m/molvolumen.php
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
Weiter mit Konzentrationsabhängigkeit der Reaktionsgeschwindigkeit ...