
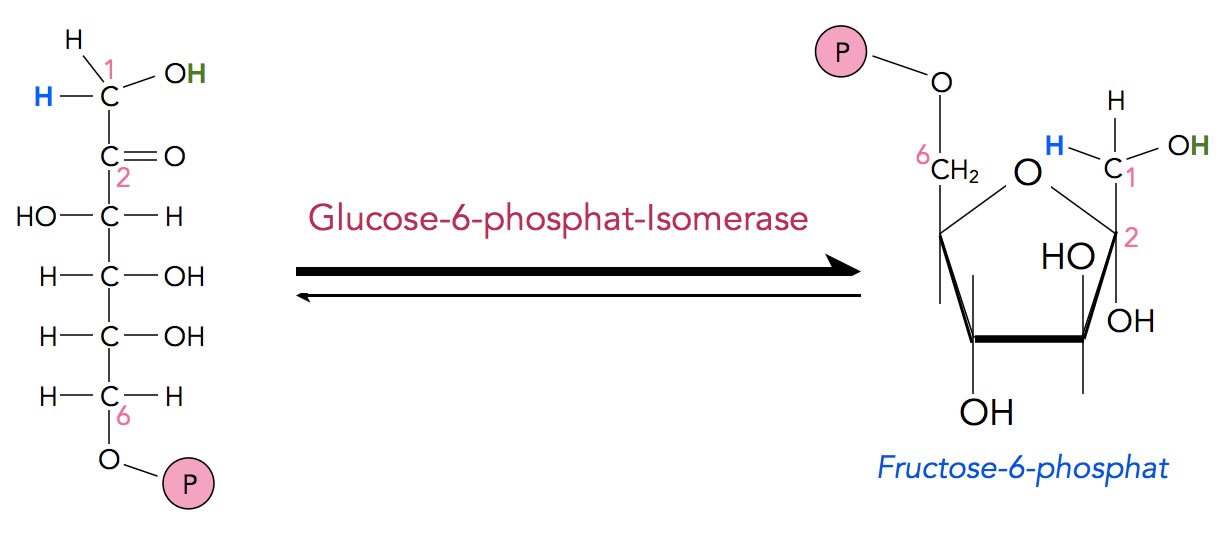
Der zweite Schritt der Glycolyse dient zur Vorbereitung des zweiten Aktivierungsschrittes durch ATP. Damit eine zweite Phosphat-Gruppe aufgenommen werden kann, muss das Glucose-Molekül zunächst umgebaut werden, so dass eine zweite CH2OH-Gruppe zur Verfügung steht, die eine Phosphat-Gruppe aufnehmen kann. Dazu wird das Glucose-Gerüst in ein Fructose-Gerüst umgewandelt.
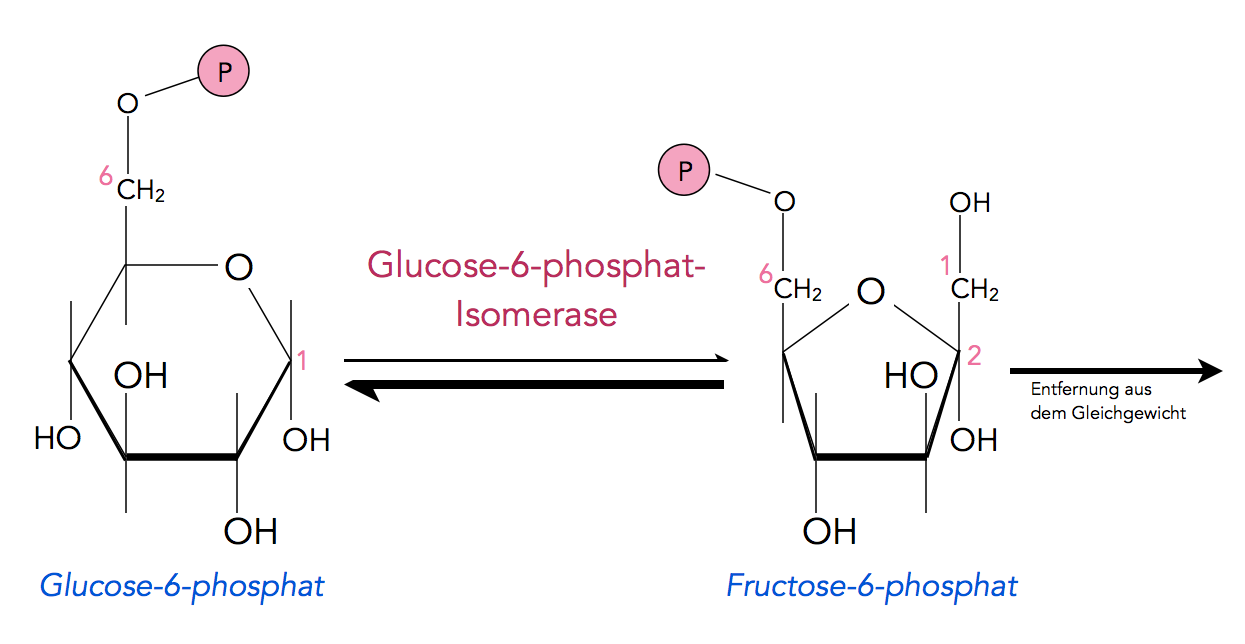
Der Schritt 2 der Glycolyse. Die Phosphat-Gruppe wird durch das P-Symbol dargestellt.
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei dieser Isomerisierung wird lediglich die Struktur des Moleküls verändert; es wird weder nennenswert Energie in das Molekül hineingesteckt, noch wird eine Oxidation oder Reduktion durchgeführt.
Dieser Reaktionsschritt ist reversibel, das chemische Gleichgewicht liegt zwar auf der Seite des Glucose-6-phosphats, da das Reaktionsprodukt Fructose-6-phosphat aber ständig weiter reagiert, wird es aus dem Gleichgewicht entfernt, und die Reaktion läuft weiter in Richtung Produkt (Prinzip des kleinsten Zwangs).
Das Enzym, das die Reaktion in beide Richtungen katalysiert, ist die Glucose-6-Phosphat-Isomerase, ein Protein, das auch außerhalb der Glycolyse wichtige Funktionen hat, z.B. als Wachstumsfaktor.
Mutationen am Gen für die Glucose-6-Phosphat-Isomerase (GPI) sollen nach neueren Erkenntnissen für einige Krankheiten verantwortlich sein, zum Beispiel für hämolytische Anämie, Arthritis und Tumorbildung (Wikipedia).
Warum ist dieser Schritt notwendig?
Es wurde bereits gesagt, dass Glucose durch zwei Phosphatgruppen aktiviert werden muss, damit die Spaltung erfolgen kann. Ein Glucose-Molekül kann aber aufgrund seiner Struktur nur eine Phosphatgruppe aufnehmen, da es nur eine exponierte CH2OH-Gruppe besitzt, nämlich am C-Atom 6. Ein Fructose-Molekül dagegen hat zwei solcher exponierter CH2OH-Gruppen (an C-Atomen 1 und 6), und kann daher zwei Phosphatgruppen aufnehmen. Die zweite Phosphatgruppe ist für die vollständige Aktivierung der Glucose notwendig.
Bei der Phosphorylierung der Glucose im ersten Schritt setzt sich das Glucose-Molekül in die Hexokinase, welche die Glucose dann nahezu komplett umschließt. Lediglich die CH2OH-Gruppe der Glucose ist noch frei zugänglich für die Phosphorylierung. Entsprechendes muss man sich jetzt auch für den folgenden Schritt vorstellen, wenn das Fructose-6-phosphat phosphoryliert wird.
Es gibt aber auch noch einen zweiten Grund für diese Umwandlung. Im Schritt 4 der Glycolyse wird das Glucose- bzw. Fructose-Molekül in zwei Hälften gespalten, die aus je drei C-Atomen bestehen. Es ist notwendig, dass das eine Spaltprodukte in das andere umgewandelt werden kann, denn nur eines der beiden Spaltprodukte kann in Schritt 5 weiterverarbeitet werden. Aus diesem Grund müssen beide Spaltprodukte der Glucose/Fructose eine Phosphatgruppe tragen, sonst könnte nämlich das eine Spaltprodukt nicht so einfach in das andere umgewandelt werden. Außerdem sollten beide Spaltprodukte eine ähnliche Struktur besitzen. Wenn man ein Fructose-Molekül spaltet, ist dies eher der Fall, als wenn man ein Glucose-Molekül spaltet, da Glucose nur eine einzige exponierte CH2OH-Gruppe besitzt, Fructose aber deren zwei.
Expertenwissen:
Einzelheiten dieses Reaktionsschrittes
Im aktuellen Lehninger [2] und in dem Wikipedia-Artikel "Glucose-6-Phosphat-Isomerase" [4] ist dieser Reaktionsschritt in Einzelheiten beschrieben worden. Ich möchte die wesentlichen Aussagen dieser Quellen hier kurz in schüler- und studentengerechter Form wiedergeben.
Schritt 2.1: Öffnung des Ringes
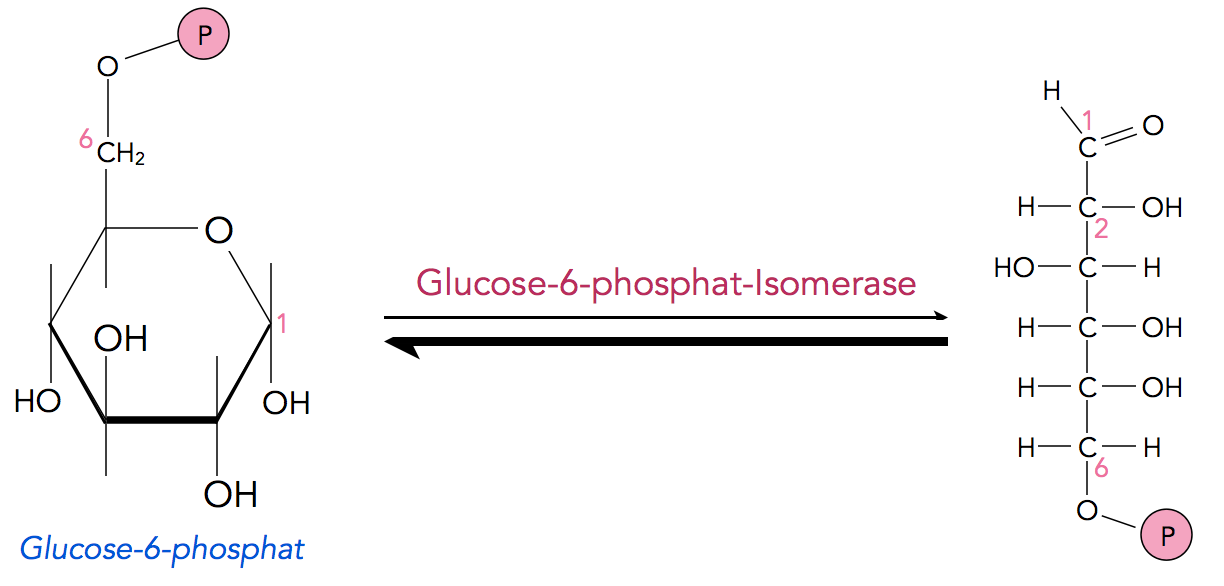
Schritt 2.1 der Glycolyse
Autor: Ulrich Helmich 2021, Lizenz: Public domain
In einer wässrigen Lösung liegen Monosaccharide wie Glucose, Fructose und ihre Phosphate hauptsächlich (zu über 90%) in der Ringform vor, die Kettenform liegt zu weniger als 10% vor. Das Enzym Glucose-6-phosphat-Isomerase beschleunigt die Isomerisierung, ohne aber die Lage des Gleichgewichts zu verschieben (das können Enzyme ja grundsätzlich nicht, sie erniedrigen nur die Aktivierungsenergie und beschleunigen dadurch die Einstellung solcher Gleichgewichte).
Schritt 2.2: Eliminierung eines Protons durch Glutaminsäure
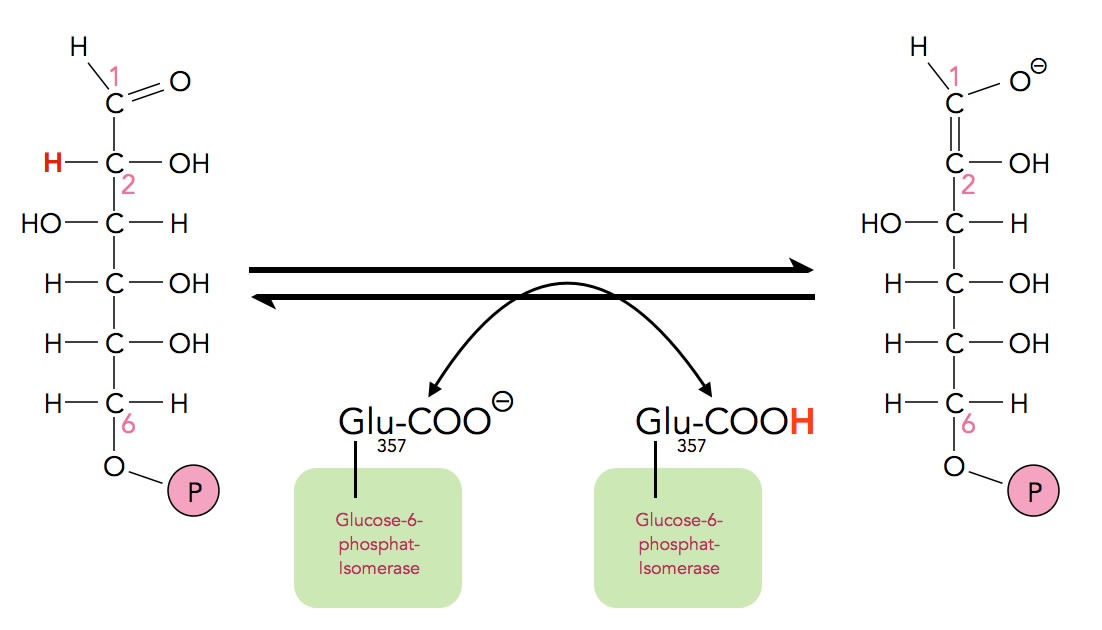
Schritt 2.2 der Glycolyse
Autor: Ulrich Helmich, Lizenz: Public domain
An der Position 357 der Glucose-6-phosphat-Isomerase befindet sich eine Glutaminsäure-Einheit mit einer negativ geladenen COO--Gruppe in ihrer Seitenkette. Daher kann diese Aminosäure als Base fungieren und ein Proton von dem C2-Atom des Substrats abstrahieren (entfernen). Zwischen dem C1- und dem C2-Atom des Glucose-6-phosphats bildet sich eine C=C-Doppelbindung aus, und das O-Atom der ehemaligen Carbonylgruppe trägt nun eine negative Ladung, schließlich fehlt dem Molekül jetzt ein Proton.
Schritt 2.3: Addition eines anderen Protons durch die gleiche Glutaminsäure
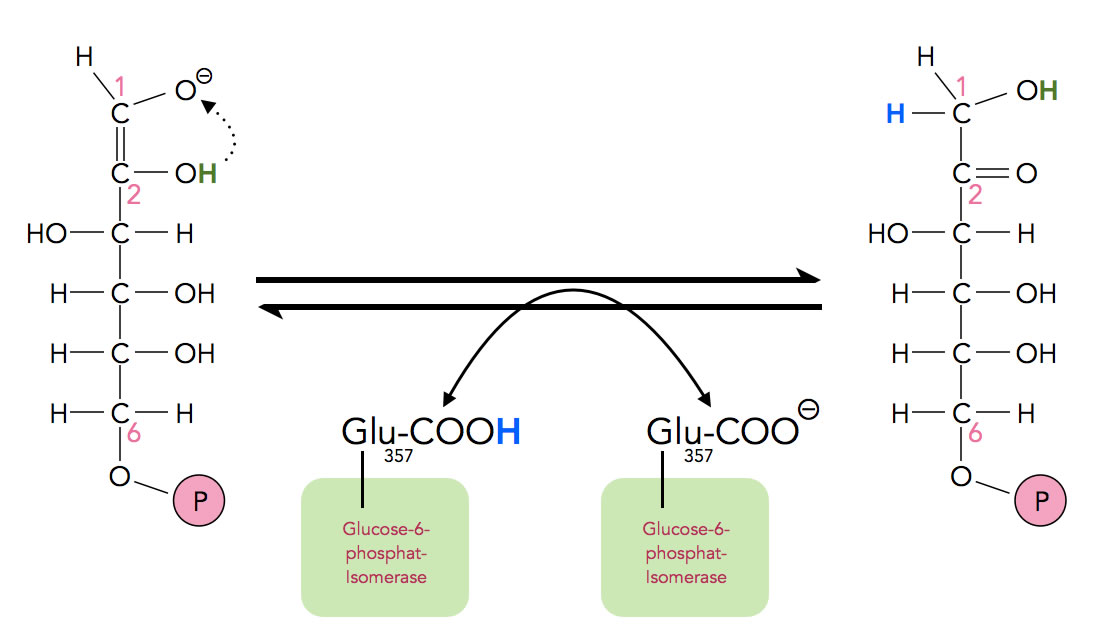
Schritt 2.3 der Glycolyse
Autor: Ulrich Helmich, Lizenz: Public domain
Die Glutaminsäure an Position 357 kann nun ihr Proton auch leicht wieder abgeben - so ist das eben bei Säuren, mal geben sie ein Proton ab und werden zur Base, dann nehmen wie wieder ein anderes Proton auf und werden erneut zur Säure. Dieses Proton von Glu357 dient nun dazu, die C=C-Doppelbindung zwischen den C1- und C2-Atomen aufzulösen, es setzt sich an das C1-Atom.
Zur Hydrierung einer C=C-Doppelbindung sind aber immer zwei H-Atome notwendig. Das zweite H-Atom kommt von der OH-Gruppe am C2-Atom und wandert zu dem negativ geladenen O-Atom am C1-Atom.
Schritt 2.4 Erneute Ringbildung
Schritt 2.4 der Glycolyse
Autor: Ulrich Helmich, Lizenz: Public domain
Im Schritt 2.3 ist nichts anderes entstanden als ein Fructose-6-phosphat-Molekül in der offenkettigen Form. Das chemische Gleichgewicht zwischen Ring- und Kettenform liegt bei Monosacchariden und ihren Phosphaten aber stets auf der Ring-Seite. Daher bildet sich die Ringform von Fructose-6-phosphat als Endprodukt des Schrittes 2.4 der Glycolyse.
Quellen:
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Wikipedia, Artikel Glucose-6-Phosphat-Isomerase.
Seitenanfang -
Weiter mit Schritt 3...