Betrachten Sie nun folgenden interessanten Versuch:
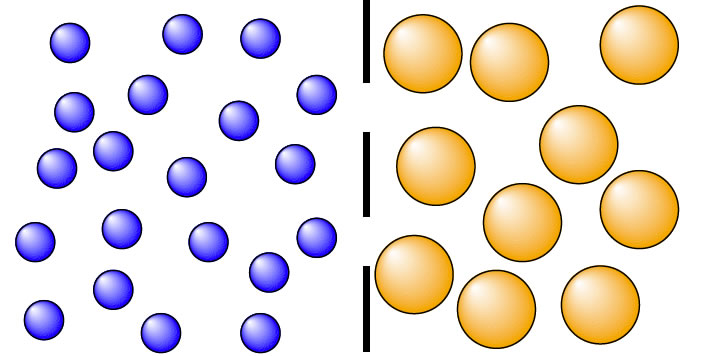
Ein interessanter Versuch mit zwei Konzentrationsgradienten
Autor: Ulrich Helmich, Lizenz: Public domain
Ein Gefäß mit einem Lösungsmittel (dessen Teilchen wieder nicht mit eingezeichnet wurden) wird durch eine semipermeable Membran in zwei gleich große Hälften geteilt. Die Membran ist permeabel für die blau dargestellten Teilchen und undurchlässig für die großen gelb dargestellten Teilchen.
Die entscheidende Frage ist jetzt: Was wird passieren (und warum)?
Lassen Sie uns gemeinsam überlegen!
Die kleinen Teilchen können ungehindert von der Membran diffundieren. Solange sie nicht chemisch mit den großen Teilchen reagieren oder auf andere Weise von den großen Teilchen beeinflusst werden, gelangt rein statistisch gesehen die Hälfte der blauen Teilchen auf die rechte Seite - Konzentrationsausgleich.
Die großen Teilchen auf der rechten Seite bewegen sich zwar auch hin- und her, sie können die Membran aber nicht durchdringen.
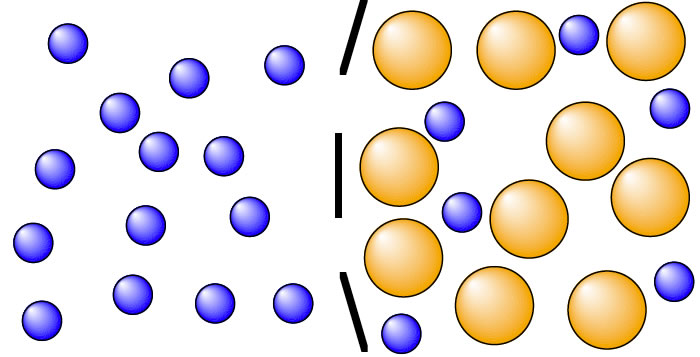
Ein interessanter Fall von Diffusion
Autor: Ulrich Helmich, Lizenz: Public domain
Das Bild oben zeigt das Ergebnis des Versuchs. Zählen Sie doch einmal die blauen Kügelchen nach, und achten Sie auf die Verformung der Membran!
Links der Membran befinden sich 14 blaue Kügelchen, rechts nur sechs. An sich sollten im Schnitt 10 Teilchen links und 10 Teilchen rechts sein (Konzentrationsausgleich). Und warum hat sich die Membran nach links ausgedehnt?
Zunächst diffundieren einige der kleineren blauen Teilchen nach rechts. Dadurch steigt der Druck auf der rechten Seite etwas an, denn die Teilchen nehmen ja einen gewissen Raum ein und drücken die Lösungsmittelteilchen sowie die großen gelben Teilchen gewissermaßen etwas auseinander. Die Membran ist allerdings flexibel und gibt diesem Druck etwas nach, indem sie sich nach links ausdehnt.
Da noch kein Konzentrationsausgleich erreicht wurde, diffundieren noch ein paar der blauen Teilchen nach rechts. Der Druck auf der rechten Seite wird größer, die Membran dehnt sich noch mehr aus.
Nach einiger Zeit kommt die Diffusion der blauen Teilchen zum Erliegen, denn der Druck auf der rechten Seite ist so groß geworden, dass er der Diffusion entgegengerichtet ist. Es kommt zu einem stabilen dynamischen Gleichgewicht.
"Dynamisches" Gleichgewicht heißt hier, dass einzelne blaue Teilchen weiterhin von links nach rechts diffundieren können, dass aber gleichzeitig andere blaue Teilchen von rechts nach links zurück diffundieren. Für den außenstehenden Betrachter passiert aber nichts Besonderes, er kann die Teilchen ja nicht sehen. Es sei denn, er oder sie benutzt Tracer-Methoden.
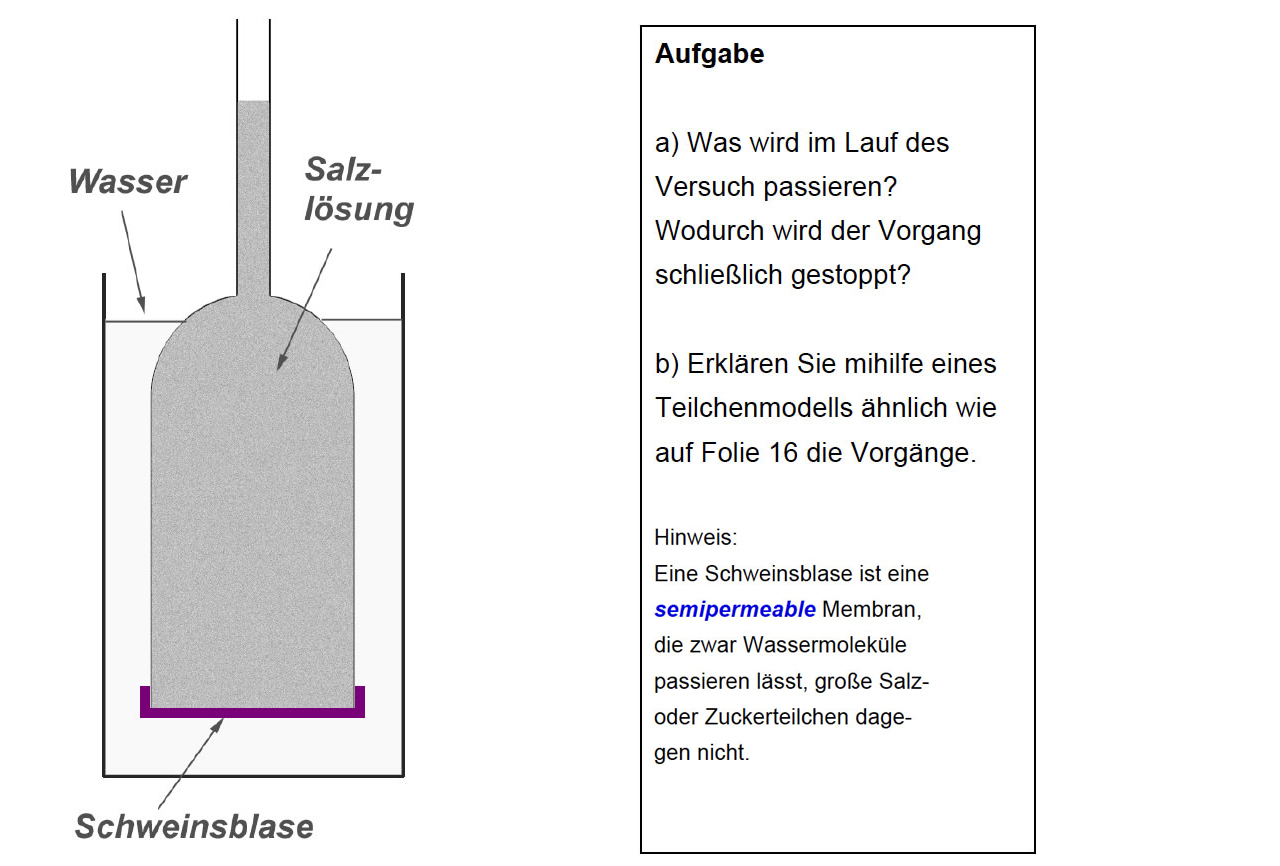
Eine häufig gestellte Aufgabe in Klausuren
Autor: Ulrich Helmich, Lizenz: Public domain
Die Abbildung oben zeigt eine häufig gestellte Aufgabe in Klausuren. Das glockenförmige Glasgefäß (Osmometer) ist unten offen, wird aber mit einer semipermeablen Membran relativ dicht abgeschlossen. Meistens nimmt man dafür eine Schweineblase, die man mit einem Gummi-Ring fest an dem Gefäß befestigt. Das Gefäß wurde vorher mit einer Kochsalzlösung gefüllt. Dann wird das ganze Gefäß mit der Membran in ein großes Becherglas mit Leitungswasser gestellt.
Man kann nun beobachten, dass die Salzlösung in dem Steigrohr des Osmometers langsam nach oben steigt.
Es passiert das Gleiche wie zuvor beschrieben. Die Salzlösung enthält große Ionen, die durch die Membran nicht hindurch diffundieren können. Die Wasser-Moleküle des äußeren Gefäßes dagegen können die Membran leicht durchdringen.
So, nun noch ein ganz wichtiger Lerntipp für Schüler und Schülerinnen, die immer Probleme mit dem Begriff der Osmose haben:
Vergessen Sie die verschiedenen kleinen und großen Teilchensorten zunächst und konzentrieren Sie sich auf das Wasser. Im Innern des Osmometers befinden sich viele Salzteilchen (oder Zuckermoleküle), daher ist dort die Konzentration des Wassers c(Wasser) kleiner als im Außenmedium. Es besteht also ein Wasser-Konzentrationsgefälle von außen nach innen (ähnlich wie bei einer Zelle, die sich in einer hypotonischen Lösung befindet). Wie jedes Konzentrationsgefälle führt das zu einer Diffusion mit dem "Ziel" des Konzentrationsausgleichs. Wasser-Moleküle diffundieren also von außen nach innen. Allerdings kommt es nie zu einem Konzentrationsausgleich, weil sich im Innern des Osmometers ein Gegendruck aufbaut, der immer größer wird und so das Hineinströmen von Wasser immer mehr erschwert.
Ein paar weitere Einzelheiten zum Vorgang der Osmose finden Sie auf dieser Lexikon-Seite.
Seitenanfang -
Weiter mit Versuchen zur Osmose...