Zunächst ein Versuch
Der Begriff Diffusion lässt sich am besten mit einem kleinen Versuch erklären:
Versuch zur Diffusion
Durchführung:
In einen Standzylinder gibt man Leitungswasser. Mit einer längeren Pipette lässt man dann langsam und vorsichtig eine Kaliumpermanganat-Lösung (KMnO4) auf den Boden des Standzylinders laufen.
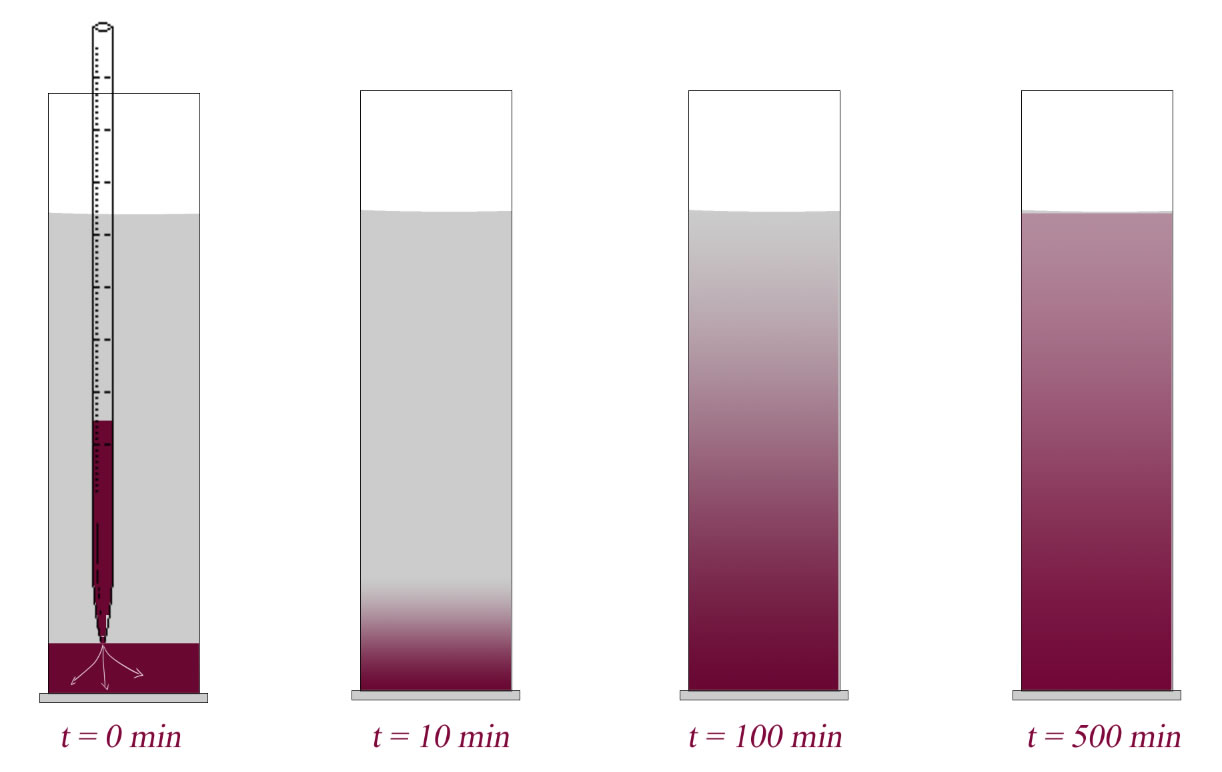
Diffusion von Kaliumpermanganat in einem Standzylinder
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Beobachtungen:
Am Anfang kann man noch eine mehr oder weniger klare Phasengrenze zwischen der Kaliumpermanganat-Lösung und dem Wasser sehen. Nach 10 Minuten ist die klare Grenze schon verwischt, nach 100 Minuten ist fast schon die gesamte Flüssigkeit violett gefärbt, aber mit einem deutlichen Farbverlauf von oben nach unten, und nach 500 Minuten ist die Flüssigkeit nahezu homogen violett gefärbt, es ist höchstens noch ein geringer Farbverlauf von oben nach unten zu erkennen, der aber im weiteren Verlauf der Zeit ganz verschwindet, so dass die Lösung überall einheitlich intensiv gefärbt ist. Nur leider hat man im Unterricht normalerweise nicht die Zeit, so lange zu warten.
Deutung / Erklärung:
Zu Beginn des Versuchs herrscht bezüglich der Kaliumpermanganat-Teilchen ein großer Konzentrationsunterschied. Auf dem Boden des Zylinders ist die Kaliumpermanganat-Konzentration c(KMnO4) sehr hoch, oben im Zylinder ist c(KMnO4) = 0.
Im Laufe der Zeit wird der Konzentrationsunterschied zwischen oben und unten aber immer kleiner, am Ende, nach ein paar Stunden oder eventuell sogar erst nach ein paar Tagen, besteht kein Konzentrationsunterschied zwischen dem oberen und dem unteren Bereich des Zylinders, es herrscht ein Zustand, der als Konzentrationsausgleich beschrieben wird.
Ursache für diesen Konzentrationsausgleich ist die Diffusion der Kaliumpermanganat-Teilchen, und die Ursache der Diffusion wiederum ist die Brownsche Molekularbewegung. Daher soll zunächst dieser wichtige Begriff erläutert werden.
Brownsche Molekularbewegung
Brownsche Molekularbewegung
Unter der Brownschen Molekularbewegung versteht man die spontane und zufällige Bewegung kleinster Teilchen in einem flüssigen oder gasförmigen Medium. Da die kleinsten Teilchen aufgrund ihrer ungerichteten Bewegungen ständig zusammenstoßen, ändern sie auch dauernd ihre Richtung und Geschwindigkeit.
Die Geschwindigkeit, mit der sich diese Teilchen bewegen, hängt von mehreren Faktoren ab:
- Je kleiner die Teilchen, desto schneller bewegen sie sich.
- Je höher die Temperatur, desto größer ist ihre durchschnittliche Geschwindigkeit.
- Je flüssiger das Medium, in dem sich die Teilchen bewegen, desto schneller sind sie.
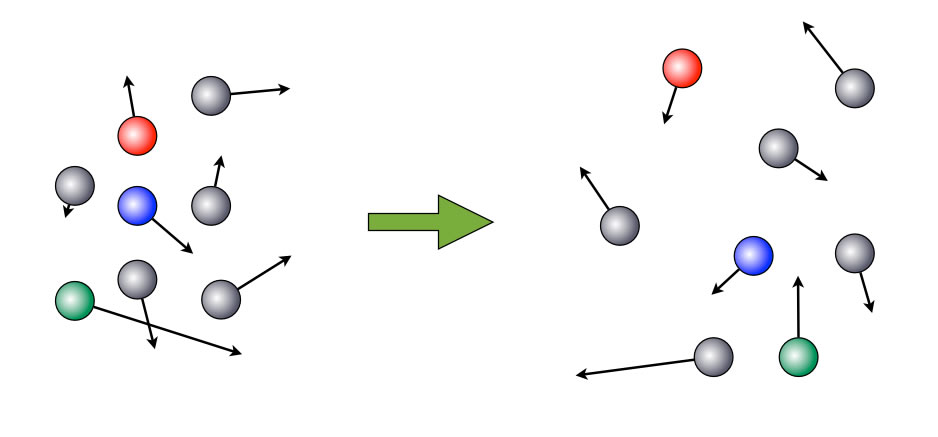
BROWNsche Bewegung von einigen Molekülen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Auf diesem Bild sieht man acht Teilchen, die sich mit unterschiedlicher Geschwindigkeit in unterschiedlichen Richtungen bewegen. Anfangs liegen die Teilchen noch relativ dicht beieinander, nach einer kurzen Zeit aber haben sich die Teilchen mehr oder weniger gleichmäßig über eine größere Fläche verteilt.
In meinem Bio-Unterricht erkläre ich die Brownsche Molekularbewegung immer mit einem kleinen Becherglas voller Marienkäfer, das man auf eine große weiße Tischfläche auskippt. Am Anfang sitzen die Käfer und Käferinnen immer noch nah beieinander, mit der Zeit breiten sie sich aber über die ganze Tischfläche aus.
Simulation der Brownschen Molekularbewegung durch das Diffusionsspiel
Für meinen Unterricht in der Jahrgangsstufe EF (Stufe 10) habe ich ein kleines Spiel entwickelt:
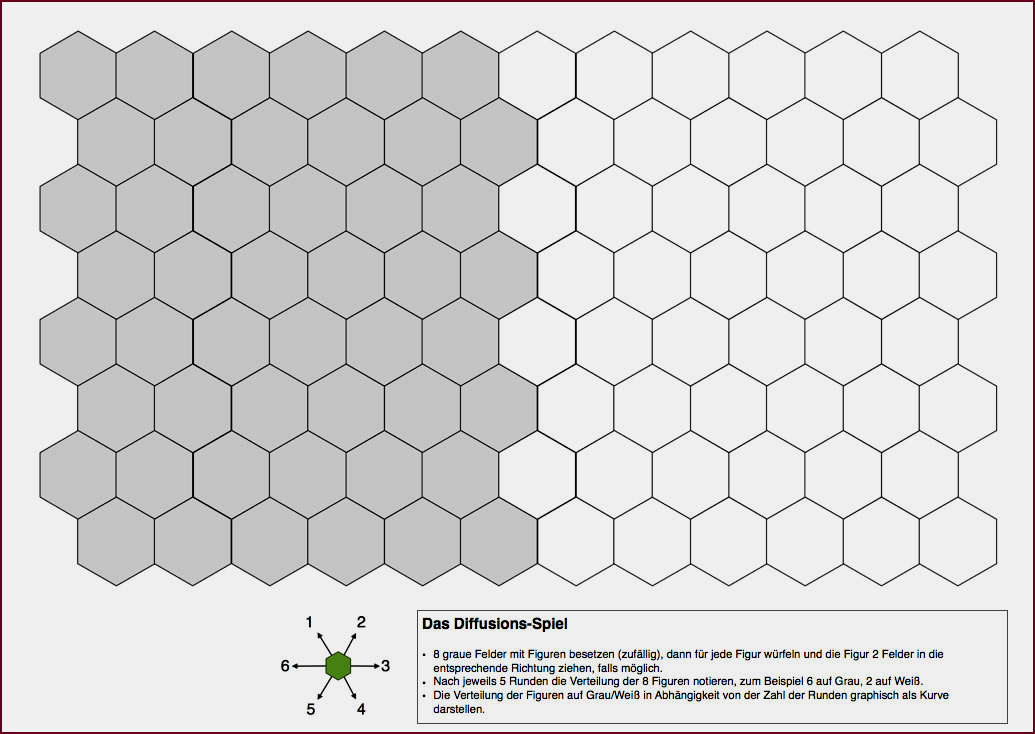
Das Diffusionsspiel (Download der PDF-Datei)
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Regeln:
- Acht graue Felder mit Figuren besetzen (zufällig), dann für jede Figur würfeln und die Figur zwei Felder in die entsprechende Richtung ziehen, falls möglich.
- Nach jeder Runde die Verteilung der acht Figuren notieren, zum Beispiel "6 auf Grau, 2 auf Weiß".
- Die Verteilung der Figuren auf den grauen/weißen Feldern in Abhängigkeit von der Zahl der Runden graphisch darstellen.
- Weitere Regeln können bei Bedarf hinzugefügt werden…
Die Schüler lernen hier sehr schnell, wie die Diffusion funktioniert. Nach wenigen Runden sind die acht Figuren gleichmäßig auf die weißen und grauen Felder verteilt. Nicht nur das; auch das Phänomen des dynamischen Gleichgewichts wird den Schülern schnell klar, wenn sie weiterspielen, nachdem sich der "Konzentrationsausgleich" eingestellt hat.
Hinweise zum Einsatz im Unterricht
Am besten wird das Spiel in Gruppenarbeit durchgeführt, mit drei oder fünf Spielern. Zwei bzw. vier Leute würfeln für je vier bzw. zwei Figuren, und der dritte bzw. fünfte Schüler protokolliert die Ergebnisse. 20 bis 30 Minuten Zeit sind mindestens einzuplanen, bis ein "Konzentrationsausgleich" erzielt wird. Die Ergebnisse sind zunächst tabellarisch festzuhalten, anschließend können sie graphisch dargestellt werden. Am besten in Form von zwei Kurven in verschiedenen Farben. Die erste Kurve zeigt die Zahl der Figuren auf den grauen Feldern, die zweite die Zahl der Figuren auf den weißen Feldern. Die "graue" Kurve beginnt dann bei dem Wert 8, da sich zu Beginn des Spiels alle 8 Figuren auf den grauen Feldern befinden. Entsprechend beginnt die "weiße" Kurve bei dem Wert 0.
Konzentrationsausgleich
Durch rein zufällige und ungerichtete Bewegungen der Teilchen kommt es mit der Zeit zu einem vollständigen Konzentrationsausgleich, wie man in dem Diffusionsspiel sehr gut erfahren kann.
Die Geschwindigkeit, mit der sich dieser Konzentrationsausgleich einstellt, hängt von mehreren Faktoren ab. Vor allem fünf Faktoren beeinflussen die Diffusionsgeschwindigkeit:
- Ein großer Konzentrationsunterschied beschleunigt die Diffusion.
- Je kleiner die zu überwindende Distanz ist, desto schneller erfolgt der Konzentrationsausgleich.
- Kleine Teilchen bewegen sich im Prinzip schneller als große Teilchen; die Diffusionsgeschwindigkeit hängt also von der Teilchenart ab.
- Ein "zähes" Lösungsmittel (hohe Viskosität) behindert die freie Diffusion, senkt also die Diffusionsgeschwindigkeit.
- Mechanische Hindernisse wie beispielsweise eine Zellmembran behindern die Diffusion.
Zu diesem Thema können Sie hier auch eine kleine Präsentation und ein Arbeitsblatt herunterladen.
Diffusion und Energie Q1, Q2
Der Vorgang der Diffusion benötigt keine zusätzliche Energie.
Die Triebkraft für die Diffusion ist das Bestreben nach einem Konzentrationsausgleich. Am Anfang herrscht ein entropiearmer, energiereicher Zustand, nämlich der Konzentrationsgradient. Am Ende herrscht ein entropiereicher, energiearmer Zustand, der Konzentrationsausgleich. Die für diesen Vorgang erforderliche Energie ist quasi als chemisches Potenzial in dem Konzentrationsgradienten selbst gespeichert.
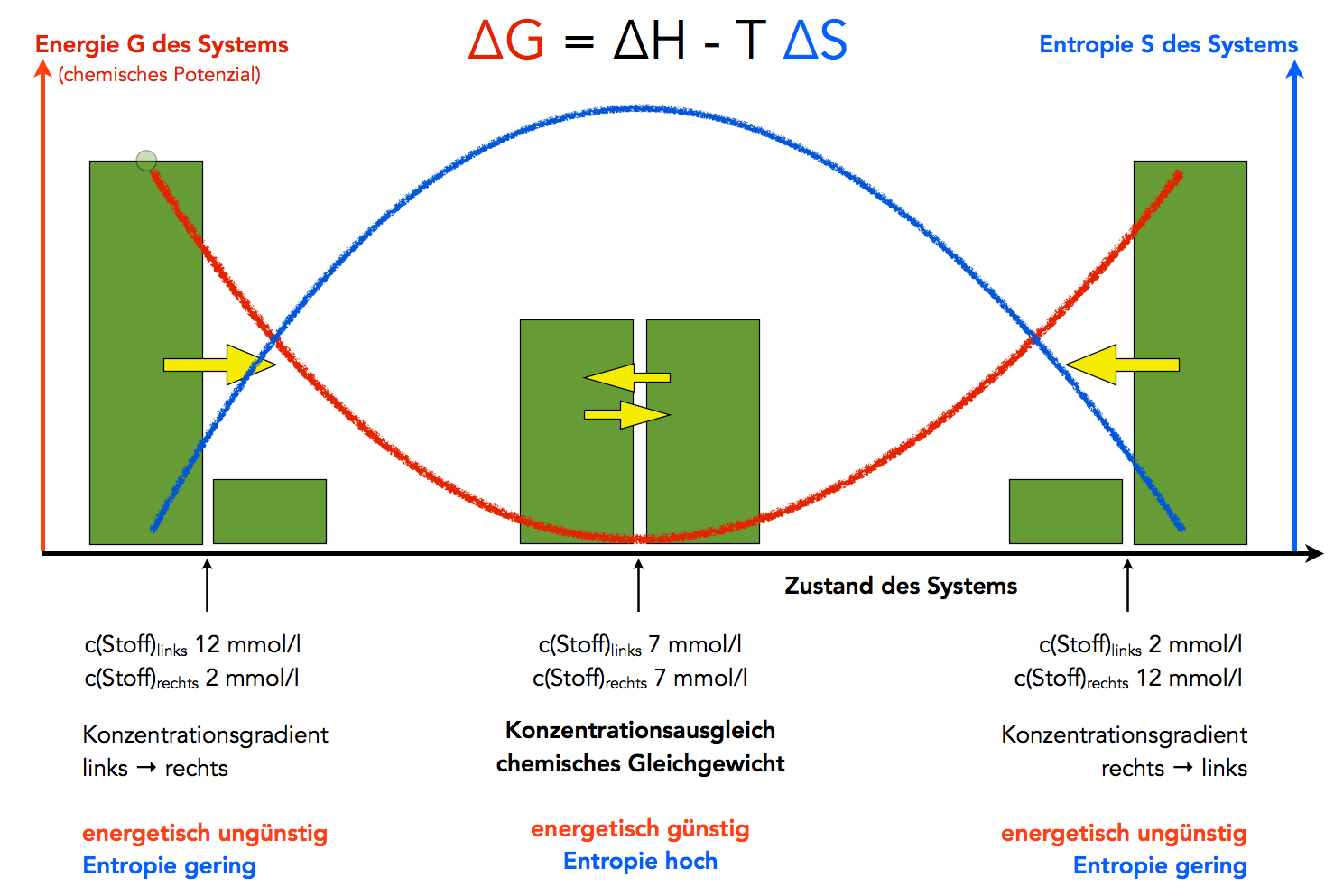
Konzentrationsgradienten streben einen energetisch günstigeren Zustand an
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Unter dem chemischen Potenzial versteht man die Fähigkeit (das Potenzial) eines chemischen Systems, Arbeit zu leisten. Das chemische Potenzial ist in der Lage, Transportarbeit zu leisten. Im Zustand des Konzentrationsausgleichs ist das chemische Potenzial des Systems gleich Null, es kann keine Arbeit mehr geleistet werden.
Die Gleichung $\Delta G = \Delta H - T\Delta S $ besagt, dass die freie Energie eines Systems von drei Faktoren abhängt: der Reaktionsenthalpie $\Delta H$, der Temperatur $T$ und der Entropie $\Delta S$.
Diese Gleichung wird beispielsweise immer dann benötigt, wenn man sich klar machen will, wieso manche endotherme Reaktionen freiwillig und spontan ablaufen. Obwohl $\Delta H > 0$ gilt, findet die Reaktion spontan statt, wenn die Entropie bei der Reaktion stark zunimmt, wenn also $\Delta S$ sehr groß ist. Dann wird der Faktor $T \Delta S$ nämlich von $\Delta H$ subtrahiert, und der Ausdruck kann negativ werden. Vorgänge mit einem $\Delta G < 0$ laufen nämlich spontan und freiwillig ab, Vorgänge mit einem $\Delta H < 0$ nicht unbedingt. Wenn die Entropie nämlich bei der Reaktion abnimmt, weil zum Beispiel aus zwei Gasen ein Feststoff wird, läuft die Reaktion nicht spontan ab, obwohl sie exotherm ist.
Näheres zu diesem wichtigen Begriff finden Sie auf den Einleitungsseiten zur Stoffwechsel-Biologie.
Seitenanfang -
Weiter mit Diffusionsgesetze...