Nachdem wir nun gesehen und hoffentlich auch verstanden haben, was man unter Diffusion versteht, wollen wir uns nun etwas genauer mit diesem Thema beschäftigen. Schauen wir uns die beiden Diffusionsgesetze an, die der deutsche Physiologe Adolf Fick (1829-1901) 1855 aufgestellt hat, und die daher auch 1. und 2. Ficksches Diffusionsgesetz genannt werden, was bei vielen Schülern und einigen Schülerinnen immer zu unterdrückter Heiterkeit führt.
Erstes Diffusionsgesetz
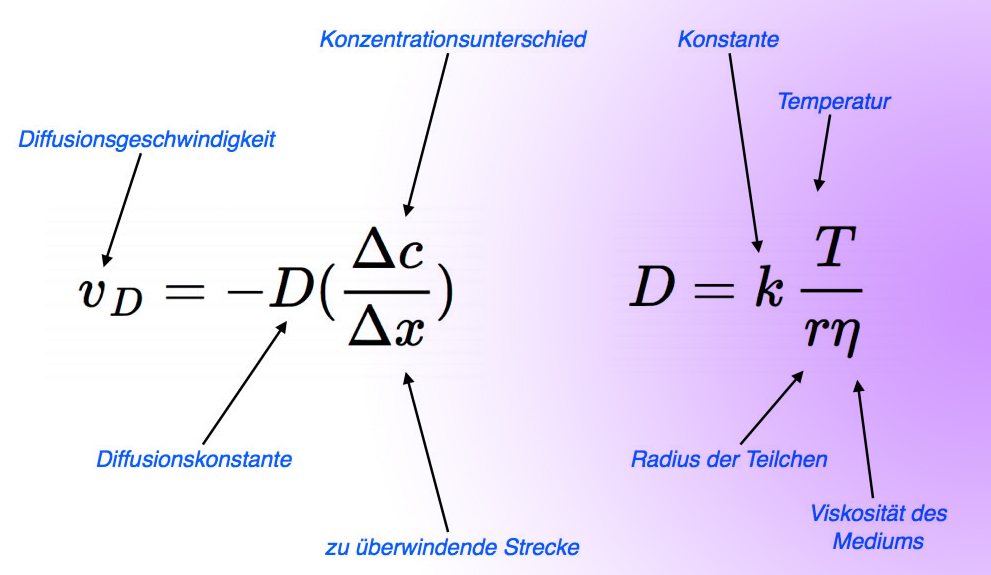
Das erste Diffusionsgesetz
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Die Abbildung zeigt das erste Diffusionsgesetz. Auf den ersten Blick sieht es recht kompliziert aus, aber wenn man genau hinschaut und seinen gesunden Menschenverstand benutzt, sollte man es verstehen. Klären wir zunächst einmal, was man unter der Diffusionsgeschwindigkeit überhaupt versteht.
Diffusionsgeschwindigkeit
Unter der Diffusionsgeschwindigkeit vD versteht man die Zahl der Teilchen, die pro Zeiteinheit und pro Flächeneinheit (senkrecht zur Diffusionsrichtung) von der Seite der höheren Konzentration zur Seite mit der niedrigeren Konzentration strömen.
Eine typischer Wert der Diffusionsgeschwindigkeit wäre also beispielsweise 10.000 Teilchen pro Sekunde und pro Quadratmillimeter, ein anderer typischer Wert wäre 0,2 mol pro Minute und Quadratmikrometer.
Faktoren, von denen vD abhängig ist
Ganz klar ist, dass die Diffusionsgeschwindigkeit von dem Konzentrationsunterschied Δc = c1 - c2 abhängt. Dabei sind c1 und c2 die beiden Konzentrationen an den beiden Orten, zwischen denen eine Diffusion stattfindet, zum Beispiel die beiden Seiten einer Membran.
Aber auch die Entfernung Δx zwischen diesen beiden Orten spielt eine wichtige Rolle. Je näher die beiden Orte x1 und x2 zusammenliegen, desto schneller findet der Konzentrationsausgleich statt, desto größer ist die Diffusionsgeschwindigkeit.
Die Diffusionsgeschwindigkeit ist also proportional zum Konzentrationsunterschied Δc und umgekehrt proportional zur Entfernung Δx, die überbrückt werden muss. Den Quotienten Δc/Δx bezeichnet man übrigens als Konzentrationsgradienten. Daher kann man auch einfach sagen: Je größer der Konzentrationsgradient, desto höher die Diffusionsgeschwindigkeit.
Wie bei jeder proportionalen Beziehung gibt es auch hier eine Proportionalitätskonstante, die in diesem Fall als Diffusionskonstante oder Diffusionskoeffizient bezeichnet wird.
Auch der Diffusionskoeffizient D hängt von mehreren Faktoren ab
So konstant, wie man jetzt vielleicht denkt, ist dieser Diffusionskoeffizient aber nicht, denn auch er hängt von mehreren Faktoren ab. Diese werden in der zweiten Gleichung der obigen Abbildung dargestellt.
Nach der RGT-Regel werden chemische und biochemische Reaktionen beschleunigt, wenn die Temperatur steigt. Bei der Diffusion ist der Diffusionskoeffizient proportional zur Temperatur. Darum steht das Symbol T für die Temperatur auch oberhalb des Bruchstrichs in der rechten Formel.
Der gesunde Menschenverstand sagt weiterhin, dass Teilchen in einem viskosem (dickflüssigem) Medium nicht so schnell diffundieren können wie in einem leichtflüssigem Medium. In der Tat ist der Diffusionskoeffizient der Viskosität des Mediums umgekehrt proportional. Das ist der Grund, warum das Symbol für die Viskosität unter dem Bruchstrich steht.
Was jetzt in der rechten Formel noch nicht berücksichtigt worden ist: Die Viskosität einer Flüssigkeit ist oft wiederum von der Temperatur abhängig. Warmer Honig ist flüssiger als Honig, der im Kühlschrank gestanden hat, wie jeder weiß. Also eigentlich müsste die rechte Formel noch komplexer sein als in der Abbildung dargestellt.
Auch der Radius der diffundierenden Teilchen ist wichtig. Je größer die Teilchen sind, desto größer ist der Widerstand, den das Medium diesen Teilchen leistet. Daher ist der Diffusionskoeffizient umgekehrt proportional zum Radius der diffundierenden Teilchen, und das Symbol für den Radius gehört ebenfalls unter den Bruchstrich.
Und wieder mal ist die rechte Formel sehr vereinfacht. Chemische Verbindungen haben nur in den seltensten Fällen kugelförmige Moleküle oder Ionen. Oft sind die Moleküle langgestreckt oder haben Ecken und Kanten, die sich vielleicht sogar ineinander verhaken können, wenn die Konzentration sehr hoch ist.
Zweites Diffusionsgesetz
Das zweite Diffusionsgesetz hier zu erläutern, dürfte etwas zu weit führen. Die generelle Aussage des zweiten Diffusionsgesetzes ist allerdings, dass die pro Zeiteinheit zurückgelegte Strecke der diffundierenden Teilchen mit dem Quadrat der Entfernung abnimmt.
Das Milbenbeispiel
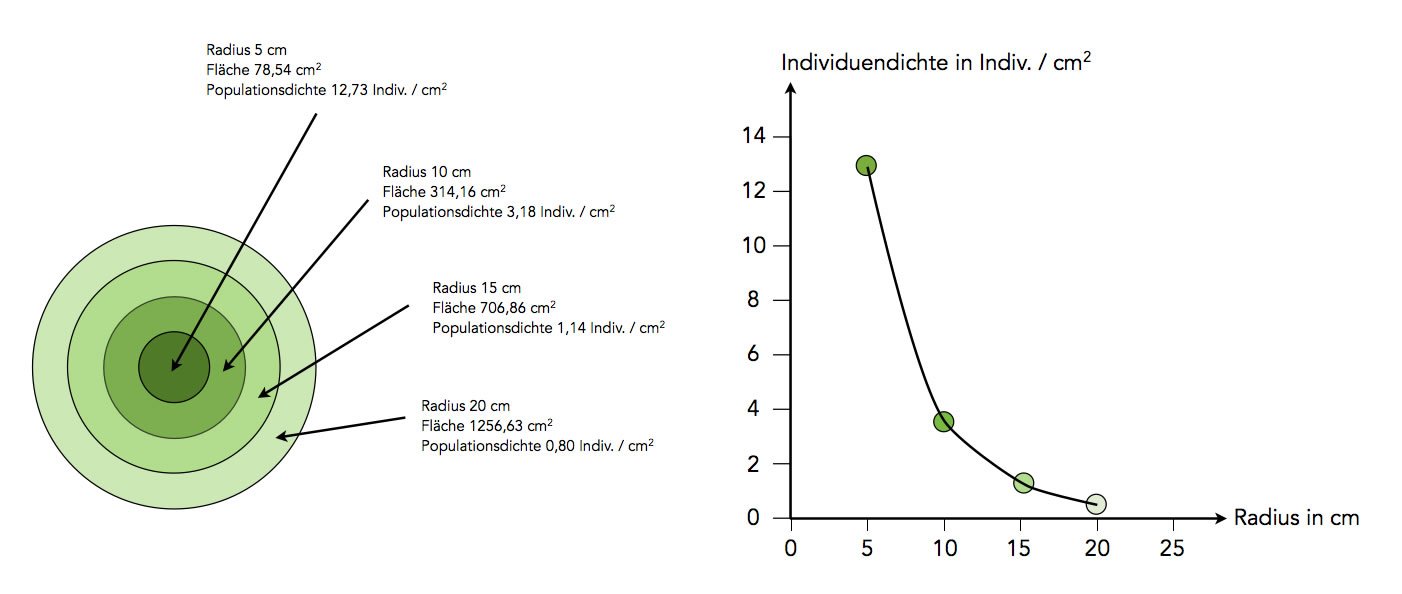
Veranschaulichung des 2. Diffusionsgesetzes
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Stellen wir uns wieder die Aktion mit dem Becherglas voller Marienkäfer vor. Nehmen wir besser Milben, die sind viel kleiner als Marienkäfer. Wir geben ein Becherglas mit 1000 Milben auf eine runde Fläche mit einem Radius von 5 cm. Der Flächeninhalt dieses Kreises beträgt 78,54 cm2. Die Individuendichte oder Populationsdichte auf dieser Fläche liegt dann bei 12,73 Individuen pro cm2.
Mit der Zeit breiten sich die Milben aus. Nach einigen Minuten kann man vielleicht feststellen, dass sie sich in einem Gebiet mit einem Radius von 10 cm verteilt haben. Die Individuendichte liegt dann nur noch bei 3,18 Tieren pro cm2. Jedes einzelne Tier kann sich aber in diesem Gebiet mit unverminderter Geschwindigkeit frei bewegen. Nur die effektive Ausbreitungsgeschwindigkeit der Tiere wird immer geringer, je größer die Fläche ist, die ihnen zur Verfügung steht bzw. die sie inzwischen eingenommen haben.
Wenn den Tieren ein Gebiet mit 20 cm Radius zur Verfügung steht, breiten sie sich auf dieser Fläche auch aus. Aber jetzt legt jedes Tier noch weitere Wege zurück - mit unverminderter individueller Geschwindigkeit. Trotzdem braucht es jetzt vier mal so viel Zeit, das Gebiet mit dem Radius von 20 cm zu "besiedeln", als ein Gebiet mit einem Radius von 10 cm. Daher ist die Populationsdichte der Tiere in dem Kreis mit 20 cm Radius auch genau viermal so klein wie in dem Kreis mit 10 cm Radius.
Konsequenzen
Die Konsequenz des zweiten Diffusionsgesetzes ist sehr entscheidend für die Zellbiologie und für die Physiologie der Tiere und Pflanzen. Ein Stofftransport, der allein durch Diffusion erfolgt, ist quasi nur auf zellulärer Ebene möglich, wo die Entfernungen sehr kurz sind. Wenn aber eine Pflanze zum Beispiel Nährsalze von den Wurzelspitzen in die Blätter transportieren will, so würde das nach dem 2. Diffusionsgesetz Tausende von Jahren dauern, wenn nicht sogar noch länger.
Auf der Chemgapedia-Seite zur Diffusion findet sich am Ende eine schöne Tabelle mit Diffusionszeiten über verschiedene Diffusionsstrecken. Sauerstoff-Moleküle brauchen demnach für eine Strecke von 8 mm ca. 4,5 Stunden, für 8 cm, die zehnfache Strecke also, aber das Hundertfache, also 18,7 Tage.
Seitenanfang -
Weiter mit Arten der Diffusion...