Definition
Carbonsäureester sind organische Verbindungen mit folgendem Aufbau:
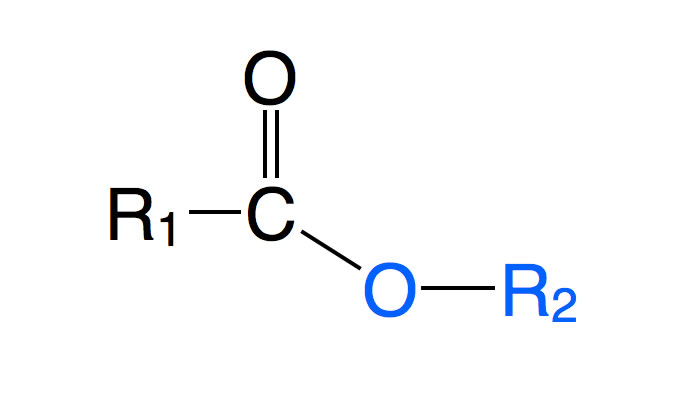
Grundstruktur eines Carbonsäureesters
Autor: Ulrich Helmich 2019, Lizenz: Public domain
An einer Carbonylgruppe C=O befindet sich auf der einen Seite ein organischer Rest R1, beispielsweise eine Methyl- oder eine Ethylgruppe, und auf der anderen Seite ein Alkohol-Rest -O-R2, beispielsweise Ethanolat (-O-C2H5).
Ein Carbonsäureester entsteht durch Reaktion eines Alkohols mit einer Carbonsäure unter Freisetzung von Wasser, es handelt sich also um eine typische Kondensationsreaktion.
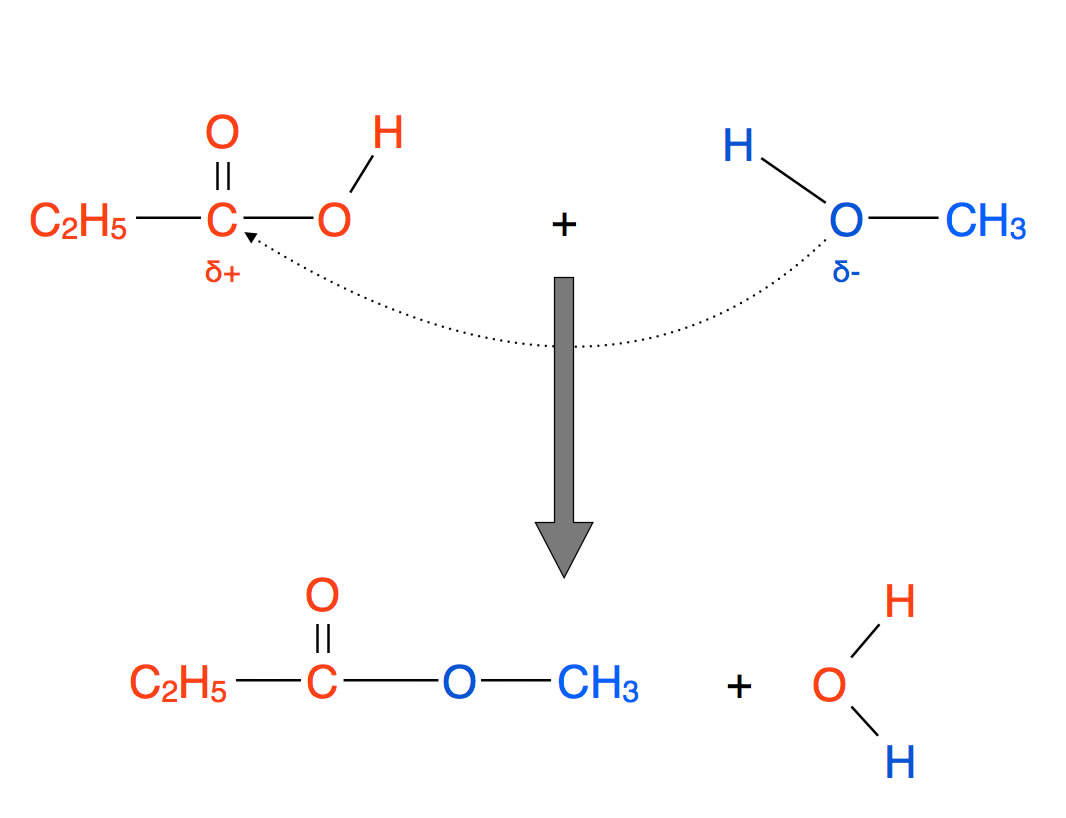
Bildung eines Esters
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Auf der Abbildung 2 sieht man, wie Propansäure und Methanol zu einem Ester reagieren. Dieser spezielle Ester wird als Propansäuremethylester oder - nach der IUPAC-Nomenklatur - als Methylpropanoat bezeichnet. Näheres zur Bezeichnung von Carbonsäureestern siehe den folgenden Abschnitt..
Alkohole mit mehr als einer OH-Gruppe können auch mehrwertige Ester bilden. Fette und Öle sind zum Beispiel Ester des dreiwertigen Alkohols Glycerin. Ein Glycerin-Molekül ist dabei mit drei Fettsäure-Molekülen verestert, daher spricht man hier auch von Triacylglyceriden oder kurz Triglyceriden. Fettsäuren sind Monocarbonsäuren mit vielen C-Atomen (häufig findet man Fettsäuren mit 18 C-Atomen).
Nomenklatur
Umgangssprachlich, alte Regeln
Die umgangssprachliche Benennung der Carbonsäureester ist recht einfach und geht schon aus den obigen drei Beispielen hervor: Zuerst wird die Carbonsäure genannt, dann der Alkylrest des Alkohols, gefolgt von der Silbe "ester".
IUPAC-Regeln
Zunächst wird der Alkyl-Rest des Esters genannt, also beispielsweise "Ethyl-", "Butyl-" etc., dann der Name des Säure-Restes, also "ethanoat" oder "butanoat".
Drei Beispiele
| Säure | Alkohol | alter Name | IUPAC-Name |
| Essigsäure | Ethanol | Essigsäure- ethylester |
Ethyl- ethanoat |
| Buttersäure | Methanol | Buttersäure- methylester |
Methyl- butanoat |
| Ameisen- säure |
Propanol | Ameisensäure- propylester |
Propyl- methanoat |
In der aktuellen Fachliteratur findet man immer noch eher die alten Bezeichnungen als die IUPAC-Namen. Bei den IUPAC-Namen werden dann oft die Trivialnamen der Säurereste verwendet, also beispielsweise Ethylacetat statt Ethylethanoat.
Synthese
Im Labor kann man Ester einfach herstellen, indem man ungefähr gleiche Stoffmengen Carbonsäure und Alkohol mit wenigen Tropfen konzentrierter Schwefelsäure versetzt und dann im Reagenzglas leicht erhitzt. Das ist übrigens ein beliebter Schülerversuch, bei dem man interessante Gerüche produzieren kann.
Hier finden Sie einen Schülerversuch, bei dem verschiedene Ester hergestellt werden.
Vorkommen
Carbonsäureester kommen in vielen natürlichen und künstlichen Aromastoffen vor. Die Ester, die in Fruchtaromen vorkommen, haben sowohl im Säure- wie auch im Alkoholanteil maximal 7 C-Atome. Einen schönen Überblick über verschiedene Fruchtaromen findet sich in der Wikipedia.
Verwendung
Ester werden häufig als Lösemittel für unpolare organische Verbindungen, vor allem für Klebstoffe, Farben und Lacke, eingesetzt. Auch werden harte und spröde Kunststoffe leichter verformbar, wenn man ihnen Ester als Weichmacher zusetzt.
Physikalische Eigenschaften
Die physikalischen Eigenschaften der Carbonsäureester werden im Organik-Kurs für die Stufe EF ausführlich erläutert, daher hier nur eine sehr knappe Darstellung:
Die Siedetemperaturen liegen im mittleren Bereich, sie sind niedriger als die Siedetemperaturen vergleichbarer Alkohole und Carbonsäuren, aber höher als die vergleichbarer Alkane. Ursache hierfür ist die Tatsache, dass Ester-Moleküle keine H-Brücken untereinander bilden können, da ein H-Brücken-Donator im Molekül fehlt. Andererseits sind Ester wegen der beiden O-Atome recht polar und bilden daher Dipole, so dass Keesom-Wechselwirkungen die Moleküle zusammenhalten.
Ester mit kurzen Alkyl-Gruppen sind gut bis mäßig wasserlöslich, was daran liegt, dass die beiden O-Atome H-Brücken-Akzeptoren sind, Ester-Moleküle können daher H-Brücken mit Wasser-Molekülen bilden.
Unpolare Verbindungen lösen sich in der Regel gut in den verschiedenen Estern, daher werden Ester gern als Lösemittel für organische Stoffe eingesetzt.
Auf dieser für die Stufe EF geschriebenen Seiten wird ausführlich auf die Siedetemperaturen und die Wasserlöslichkeit der Ester eingegangen.
Chemische Eigenschaften / Reaktionen
Die wohl wichtigste chemische Eigenschaft der Carbonsäureester ist die Tatsache, dass sie leicht hydrolytisch in ihre Bestandteile gespalten werden können - Alkohol und Carbonsäure.
Die Hydrolyse ist die Umkehrreaktion der Esterbildung, und beide Reaktionen stehen in einem chemischen Gleichgewicht miteinander. Bis zur Einstellung eines solchen Gleichgewichtes kann es bei vielen Estern recht lange dauern. Bei der Bildung von Essigsäureethylester (Ethylethanoat) dauert es beispielsweise mehrere Monate, bis sich ein Gleichgewichtszustand eingestellt hat.
Ester können nicht nur durch Wasser in ihre Bestandteile zerlegt werden, sondern auch durch andere Verbindungen. Vor allem Ammoniak ist hier zu nennen.
Die Ammonolyse läuft im Prinzip genau so ab wie die Hydrolyse, nur wird statt Wasser H2O Ammoniak NH3 eingesetzt.
Statt Ammoniak kann auch ein organisches Amin H2N-R eingesetzt werden, man spricht dann von einer Aminolyse.
Auch die Alkoholyse ist eine Reaktion der Ester. Die Alkoholyse läuft ebenfalls wie die Hydrolyse ab, nur wird hier statt Wasser ein Alkohol R-OH eingesetzt.
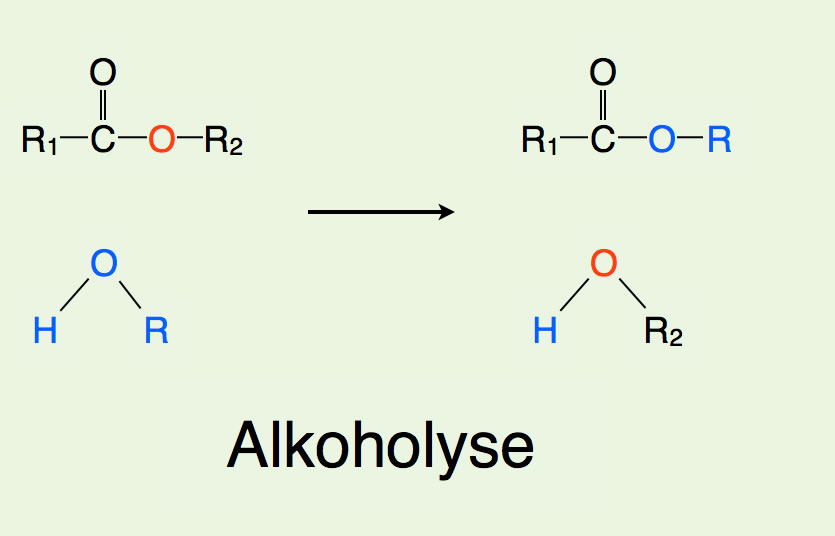
Alkoholyse eines Esters
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Interssant ist, dass bei der Alkoholyse ein neuer Ester und ein neuer Alkohol entstehen.