Carbonsäuren und Alkohole können zu Carbonsäureestern reagieren. Dabei wird Wasser abgespalten, es handelt sich also um eine Kondensation. Der genaue Reaktionsmechanismus dieser Veresterung soll auf dieser Seite Schritt für Schritt erklärt werden.
Allerdings sind Carbonsäuren nicht besonders reaktiv. Die Veresterung ist eine Gleichgewichtsreaktion, bei der das chemische Gleichgewicht nicht allzu weit auf der Seite der Produkte liegt. Die Ausbeute an Estern ist also nicht besonders hoch.
Eine wesentlich höhere Ester-Ausbeute erhält man, wenn man statt der Carbonsäure das entsprechende Carbonsäurechlorid benutzt. Dieser Art der Veresterung läuft nach einem anderen Mechanismus ab, den ich auf der Seite "Esterbildung aus einem Säurechlorid" erklärt habe.
Schritt 1: Protonierung der Säure

Im ersten Schritt gibt die Schwefelsäure (oder auch eine andere Säure) ein Proton an das Carbonyl-O-Atom der Carbonsäure ab. Dies ist eine einfache Säure-Base-Reaktion, eine Protolyse, sowohl nach Brönsted wie auch nach Lewis.
Rechts im Bild sieht man, dass es drei verschiedene Resonanzstrukturen des sich bildenden Kations gibt. Die positive Ladung, die durch das Proton in das Molekül eingebracht wurde, kann sich über die beiden O-Atome und das C-Atom der Carboxy-Gruppe verteilen; die positive Ladung ist also delokalisiert, was zu einer gewissen Stabilisierung dieses Ions führt (Mesomerie-Stabilisierung).
Schritt 2: Nucleophile Anlagerung eines Alkohols
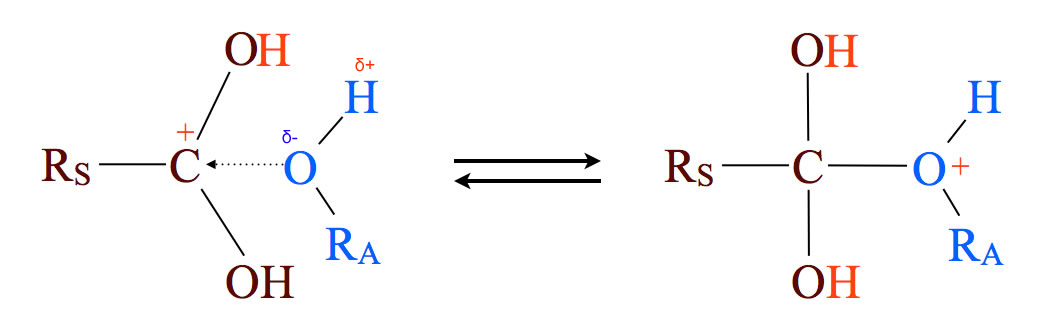
Ein positiv geladenes Carbokation mit einer leeren Kugelwolke ist ein unwiderstehliches Angriffsziel für ein Molekül mit einem nucleophilen Zentrum wie beispielsweise Ethanol. Die positive Ladung des Carbokations geht dann auf das elektronegative und nucleophile O-Atom des Alkohols über, es entsteht ein instabiles Gebilde mit einem dreibindigem Sauerstoff, das an ein Oxonium-Ion erinnert.
Schritt 3: Umlagerung des Protons
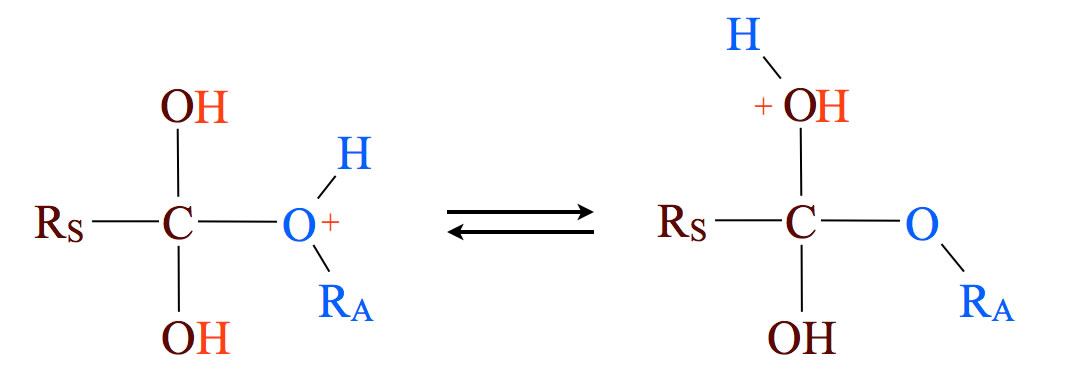
Im dritten Reaktionsschritt findet eine Umlagerung des Protons statt. Es "wandert" vom Alkohol-O-Atom zur Hydroxygruppe der Carbonsäure. Dies ist ein wichtiger Schritt, denn so wird die Abspaltung von Wasser eingeleitet, das ja das charakteristische Reaktionsnebenprodukt einer Kondensation ist.
Hier könnte ein kritischer Geist einwenden: "Woher weiß das Proton eigentlich, dass es im nächsten Schritt für die Abspaltung von Wasser benötigt wird?". Natürlich "weiß" das Proton das nicht. Man muss sich das Ganze eher unter dem Wahrscheinlichkeits-Aspekt vorstellen. Wenn ein Proton zufällig vom O-Atom des Alkohols zum O-Atom der Säure wechselt, ist anschließend die Abspaltung von Wasser energetisch sehr günstig. Wandert das Proton zu einem anderen Atom, so bringt das keinen energetischen Vorteil, und wenn das Proton überhaupt nicht wandert, ist das energetisch auch nicht vorteilhaft. Die Moleküle, bei denen das Proton also "zufällig" zum richtigen O-Atom wandert, können Wasser abspalten und damit weiterreagieren.
Schritt 4: Abspaltung von Wasser
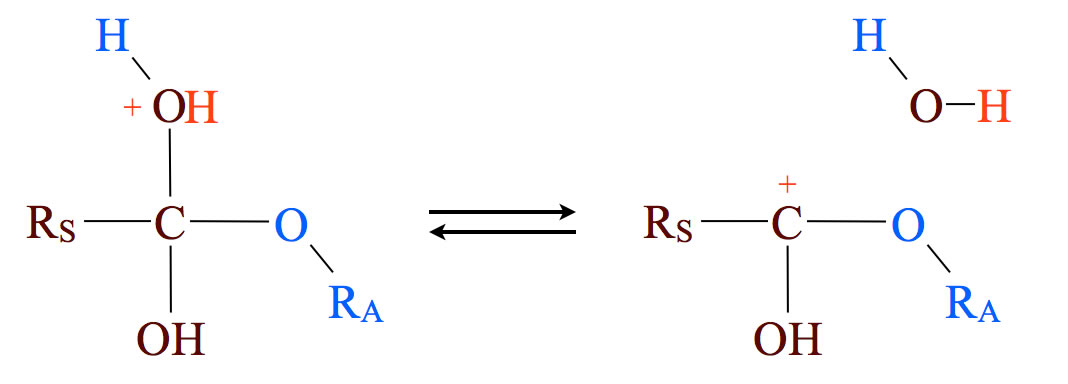
Nach der Abspaltung von Wasser ist wieder ist ein Carbeniumion entstanden. Theoretisch könnte sich jetzt ein weiteres Nucleophil anlagern, das dann aber wieder zu einem energetisch ungünstigen instabilden Zwischenprodukt führen würde.
Schritt 5: Zurückgewinnung des Protons
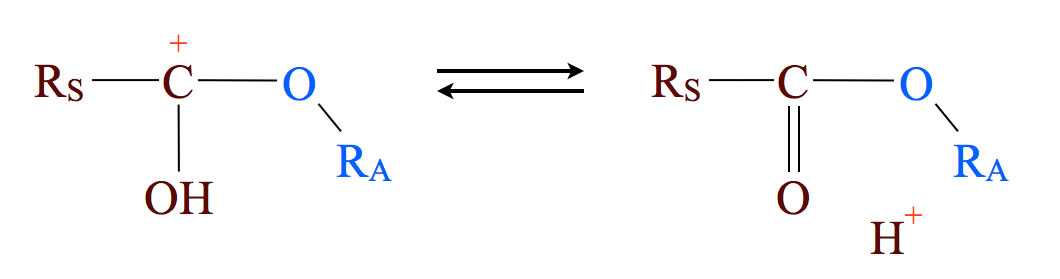
Statt dessen wird jetzt ein Proton abgegeben. Der negativ geladene Schwefelsäure-Rest erhält dadurch ein Proton zurück, und es entsteht Schwefelsäure und der Ester. Die Schwefelsäure taucht in der Gesamtgleichung nicht auf, die war ja nur der Katalysator der Reaktion.
In diesem Lexikon-Artikel finden Sie viele Details über homogene (und heterogene) Katalyse.
Zusammenfassung
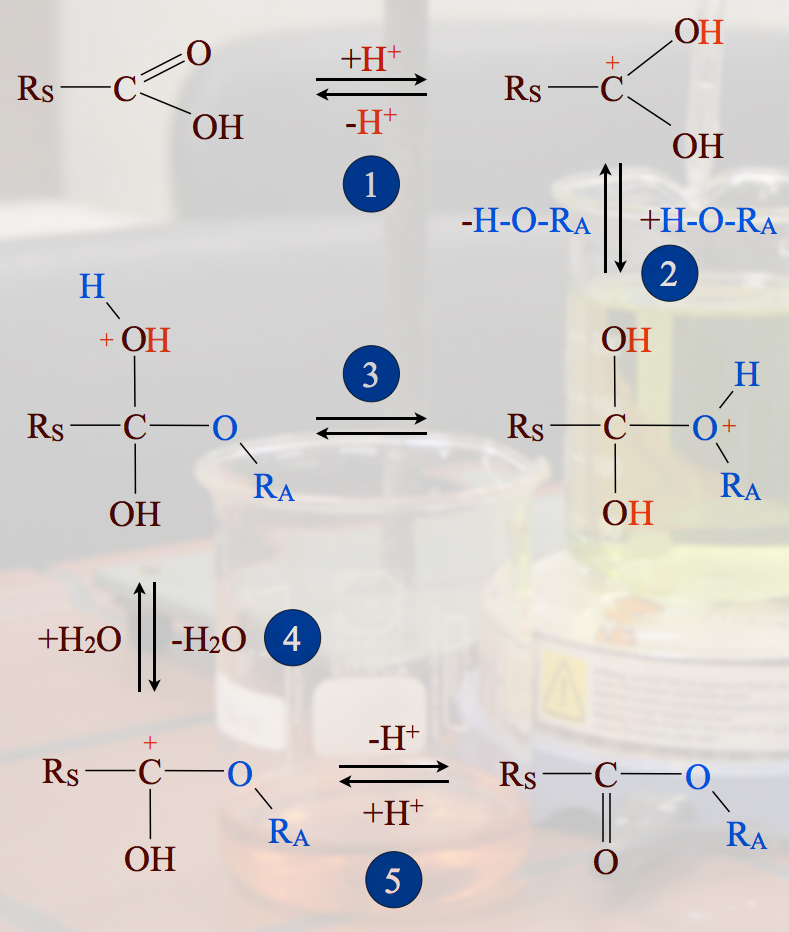
Die Zusammenfassung der sauer katalysierten Esterbildung
Sämtliche Reaktionsschritte der säurekatalysierten Veresterung sind reversibel, die Rückreaktion wird dann als saure Esterhydrolyse oder saure Esterspaltung bezeichnet. Neben der sauren Esterhydrolyse gibt es auch eine alkalische Esterhydrolyse, die aber nach einem völlig anderen Mechanismus abläuft, der auch als Verseifung bezeichnet wird.