Allgemeines EF
Die Carbonsäuren bzw. Alkansäuren sind eine wichtige Stoffgruppe der Organischen Chemie. Carbonsäuren sind Kohlenwasserstoffe, bei denen H-Atome durch Carboxy-Gruppen -COOH ersetzt wurden.
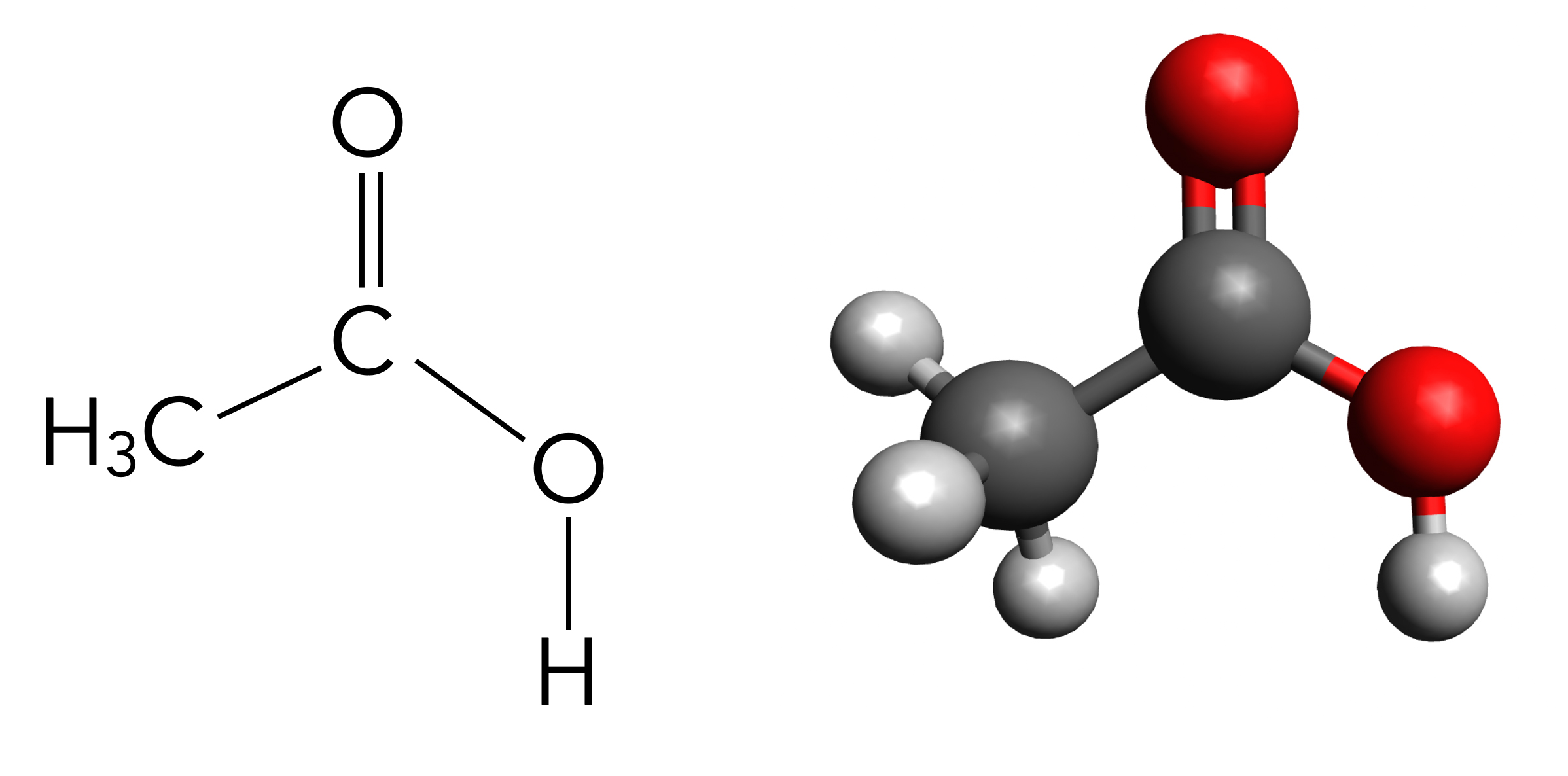 Strukturformel von Ethanal und Ethansäure im Vergleich
Strukturformel von Ethanal und Ethansäure im Vergleich
Autor: Ulrich Helmich 2025, Lizenz: Public domain.
Hier sehen wir die Strukturformel der Essigsäure CH3-COOH. Essigsäure ist zwar nicht die einfachste Carbonsäure, aber die wohl bekannteste. Die einfachste Carbonsäure ist die Ameisensäure H-COOH.
Die funktionelle Gruppe der Carbonsäuren ist die Carboxy-Gruppe, kurz COOH-Gruppe. Auch der veraltete Name Carboxyl-Gruppe ist noch geläufig.
Die Carboxy-Gruppe bedingt den Säurecharakter EF, Q1
Die Carboxy-Gruppe ist verantwortlich für den sauren Charakter der Carbonsäuren, denn ihre OH-Gruppe kann das H-Atom heterolytisch als Proton H+ abspalten. Übrig bleibt dann der Säure-Rest mit der negativ geladenen Carboxylat-Gruppe COO-.

Carbonsäuren als Protonendonatoren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Dieses Bild zeigt die Protolyse der Ethansäure (= Essigsäure). Wie jede Protolyse ist auch die Protolyse der Essigsäure eine Gleichgewichtsreaktion. Da Essigsäure aber nur eine mittelstarke Säure ist, liegt das chemische Gleichgewicht stark auf der linken Seite.
Starke Säuren wie Chlorwasserstoff geben ihr Proton sehr leicht ab, daher liegt das Protolyse-Gleichgewicht stark auf der rechten Seite (Produktseite). Mittelstarke und schwache Säuren geben ihr Proton nicht so leicht ab, das Gleichgewicht liegt dann fast ausschließlich auf der linken Seite (Eduktseite).
Der Säurerest der Essigsäure, das CH3-COO--Ion, wird als Acetat-Ion bezeichnet, und die Salze der Essigsäure heißen entsprechend Acetate.
Das Acetat-Ion ist eine recht starke Base, nimmt also sehr leicht wieder ein Proton auf.
Die Carboxylatgruppe COO- ist mesomeriestabilisiert, daher entsteht sie relativ leicht aus der Carboxygruppe. Solche Einzelheiten und mehr können Sie auf der Lexikon- und Vertiefungsseite zur Carboxygruppe nachlesen.
Carbonsäuren sind Oxidationsprodukte von Aldehyden EF
Ein Beispiel

Oxidation eines Aldehyds
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir die Oxidation von Ethanal (Acetaldehyd) zu Ethansäure (Essigsäure). Bei dieser Oxidation nimmt das Ethanal-Molekül ein Sauerstoff-Atom auf, daher handelt es sich auch um eine Oxidation im klassischen Sinne (Oxidation = Aufnahme von Sauerstoff). Wie die Oxidationszahlen des C-Atoms zeigen, gibt Ethanal bei dieser Oxidation aber auch zwei Elektronen ab, also handelt es sich auch um eine Oxidation im modernen Sinne (Oxidation = Abgabe von Elektronen). Mit Hilfe der FEHLING-Probe lässt sich gut zeigen, dass Aldehyde oxidierbar sind.
Als Oxidationsmittel für die Oxidation von Aldehyden zu Carbonsäuren können Chrom(VI)-Verbindungen wie CrO3 (Chromtrioxid) oder K2Cr2O7 (Kaliumdichromat), KMnO4 (Kaliumpermanganat), Ag2O (Silberoxid) oder H2O2 (Wasserstoffperoxid) eingesetzt werden.
Oxidation von Alkoholen führt ebenfalls zu Carbonsäuren
Bei der Essig-Herstellung wird Ethanol mit Hilfe von Luftsauerstoff zunächst zu Ethanal oxidiert (siehe Oxidation von Alkoholen). Essigsäurebakterien oxidieren Ethanal dann zu Essigsäure weiter. Das machen sie natürlich nicht aus Eigennutz, sondern sie gewinnen Energie aus dieser exothermen Reaktion.
Diese Seite, in erster Linie für die Stufe EF geschrieben, erläutert relativ ausführlich, wie die Oxidation eines Alkohols zu einem Aldehyd funktioniert. Im Prinzip kann man dies auch auf die Oxidation von Aldehyden zu Carbonsäuren übertragen.
Ein zweites wichtiges Beispiel hat wieder mit Ethanol zu tun. Wenn man Ethanol getrunken hat, baut der Körper mit Hilfe des Enzyms Alkoholdehydrogenase (ADH) den Alkohol zu Ethanal ab. Ethanal wird dann durch andere Enzyme zu Essigsäure oxidiert, die für den Körper relativ unschädlich ist. Ethanal dagegen ist giftig und verursacht den sogenannten "Kater", also Übelkeit, starke Kopfschmerzen und so weiter.
Carbonsäuren sind recht reaktionsfreudig, sie können zu Aldehyden oder Alkoholen reduziert werden, durch Decarboxylierung können sie ihre Carboxy-Gruppe verlieren, oder sie können Nucleophile oder Elektrophile an ihre C=O-Doppelbindung addieren (Nucleophile Addition). Carbonsäure-Derivate wie zum Beispiel Säurechloride (COCl statt COOH) können auch eine nucleophile Substitution eingehen. Ein Spezialfall dieser Reaktion ist die Veresterung, bei der Carbonsäuren unter Wasseraustritt mit Alkoholen reagieren.
Carbonsäuren im Alltag EF
Dieses Thema ist für die Stufe EF ein sehr wichtiges Thema. Daher habe ich hierfür eine eigene Seite angelegt:
Diese Seite ist in zwei große Teile gegliedert:
- Carbonsäuren in Lebensmitteln
- Carbonsäuren in der Technik und im Haushalt
Reaktionen der Carbonsäuren Q1
Reaktionen der Carbonsäuren sind ein wichtiges Thema vor allem für die Stufen Q1 und Q2. Für Schüler(innen) der Stufe EF bzw. Klasse 10 reicht es eigentlich, wenn Sie wissen, dass Carbonsäuren mit Alkoholen Ester bilden und dass diese Ester wichtige Geruchs- und Geschmacksstoffe sind (natürlich nicht alle Ester, manche davon sind auch hochgiftig).
Auf dieser Folgeseite finden Sie die wichtigsten Reaktionen der Carbonsäuren. Diese Seite richtet sich vor allem an Schüler(innen) der Qualifikationsphase.
Eine weitere Seite zu den Reaktionen der Carbonsäuren. Diese Seite richtet sich an Studienanfänger(innen) der Fächer Chemie, Biologie etc.