
Hier wird der klassische Versuch der Oxidation eines primären, eines sekundären und eines tertiären Alkohols mit dem Oxidationsmittel Kaliumpermanganat gezeigt.
Deutung:
Der primäre Alkohol Butan-1-ol wird durch die Kaliumpermanganat-Lösung oxidiert, es entsteht Butanal, ein Aldehyd bzw. Alkanal.
Auch der sekundäre Alkohol Butan-2-ol wird durch die Kaliumpermanganat-Lösung oxidiert, hierbei entsteht Butanon, ein Keton bzw. Alkanon.
Der tertiäre Alkohol 2-Methyl-propan-2-ol reagiert nicht mit dem Oxidationsmittel, er kann nicht oxidiert werden. Warum das so ist, wird weiter unten erklärt.
In meinem eigenen Unterricht führe ich immer noch einen zweiten Versuch durch:
Hier wird ein zweiter klassischer Versuch der Alkohol-Oxidation mit dem Oxidationsmittel Kupferoxid gezeigt.
Deutung:
Betrachten wir zunächst eine graphische Darstellung der gesamten Reaktionen, die während der Umsetzung des Alkohols mit dem heißen Kupferblech ablaufen:
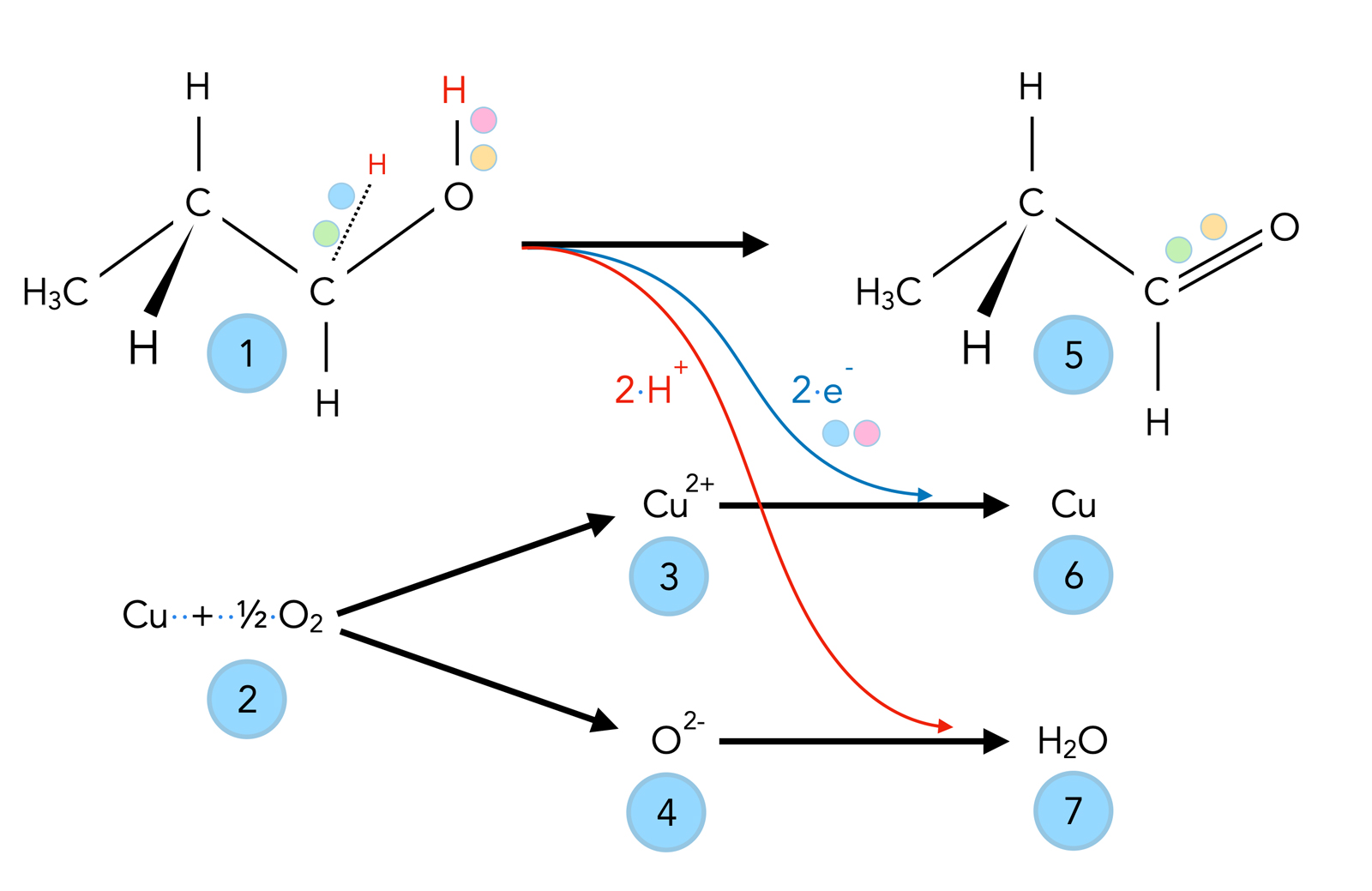
Oxidation eines primären Alkohols mit Kupferoxid CuO
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Links oben in dem Bild sehen wir den organischen Ausgangsstoff Propan-1-ol (1) sowie die beiden anorganischen Ausgangsstoffe Kupfer und Sauerstoff (2).
Wenn das Kupferblech stark erhitzt wird, bildet sich Kupferoxid, das aus Kupfer-Ionen (3) und Oxid-Ionen (4) besteht.
Bei der Oxidation verliert der Alkohol zwei Wasserstoff-Atome (rot gezeichnet), die man aber als zwei Protonen und zwei Elektronen auffassen muss.
Die beiden Elektronen werden von den Kupfer-Ionen aufgenommen, die dadurch zu Kupfer-Atomen reduziert werden (6). Die beiden Protonen reagieren mit den Oxid-Ionen (4) zu Wasser-Molekülen (7).
Die Endprodukte der Reaktion sind also Propanal, ein Aldehyd, und Wasser.
Die Bindungselektronen der einen C-H-Bindung und der O-H-Bindung in dem Edukt Propan-1-ol sind in verschiedenen Farben hervorgehoben worden, um zu zeigen, wie die C=O-Doppelbindung im Produkt Propanal entsteht. Je ein Elektron der C-H- und der O-H-Bindung wird für die Bildung der Doppelbindung verwendet, und je ein Elektron dieser beiden Bindungen wird für die Reduktion der Kupfer-Ionen benötigt.
Der sekundäre Alkohol wird ebenfalls durch die Kupfer-Ionen oxidiert, wobei die Kupfer-Ionen zwei Elektronen aufnehmen und zu metallischen Kupfer-Atomen werden. Allerdings entsteht hier kein Aldehyd, sondern ein Keton.
Diese beiden neuen Stoffklassen - Aldehyde und Ketone - wollen wir jetzt noch etwas näher kennenlernen.
Aldehyde
Wenn man primäre Alkohole oxidiert, erhält man Aldehyde (Alkohol - dehydriert). Handelt es sich bei dem primären Alkohol um ein Alkanol, also den Abkömmling eines Alkans, so wird der gebildete Aldehyd auch als Alkanal bezeichnet.
Aldehyde = organische Verbindungen mit einer Aldehydgruppe -CH=O.
Alkanale = Aldehyde, die sich von einem Alkan ableiten lassen.
Ketone
Wenn man sekundäre Alkohole oxidiert, erhält man Ketone, die mit den Aldehyden verwandt sind, aber etwas andere physikalische und chemische Eigenschaften haben. Handelt es sich bei dem sekundären Alkohol um ein Alkanol, so wird das gebildete Keton auch als Alkanon bezeichnet.
Ketone = organische Verbindungen mit einer Ketogruppe -C=O.
Alkanone = Ketone, die sich von einem Alkan ableiten lassen.
Tertiäre Alkohole
Tertiäre Alkohole lassen sich überhaupt nicht mehr oxidieren - es sei denn "mit Gewalt", zum Beispiel durch Verbrennen. Dann entstehen Wasser und Kohlendioxid, aber keine anderen organischen Verbindungen.
Warum lassen sich tertiäre Alkohole nicht mehr oxidieren? Diese Frage wird von Schülern häufig im Unterricht gestellt. Hier eine einfache Erklärung:
Wenn ein Alkohol oxidiert wird, so werden ihm zwei H-Atome (eigentlich: zwei Protonen und zwei Elektronen) entzogen. Das eine H-Atom sitzt an der OH-Gruppe des Alkohols, das andere H-Atom an dem C-Atom, das die OH-Gruppe trägt.
Bei einem primären Alkohol (1) besitzt dieses C-Atom zwei H-Atome, beim Methanol sogar drei H-Atome. Die Oxidation ist also kein Problem. Bei einem sekundären Alkohol (2) hat dieses C-Atom genau ein H-Atom, auch hier kann daher eine Oxidation durch Wasserstoff-Entzug ablaufen.
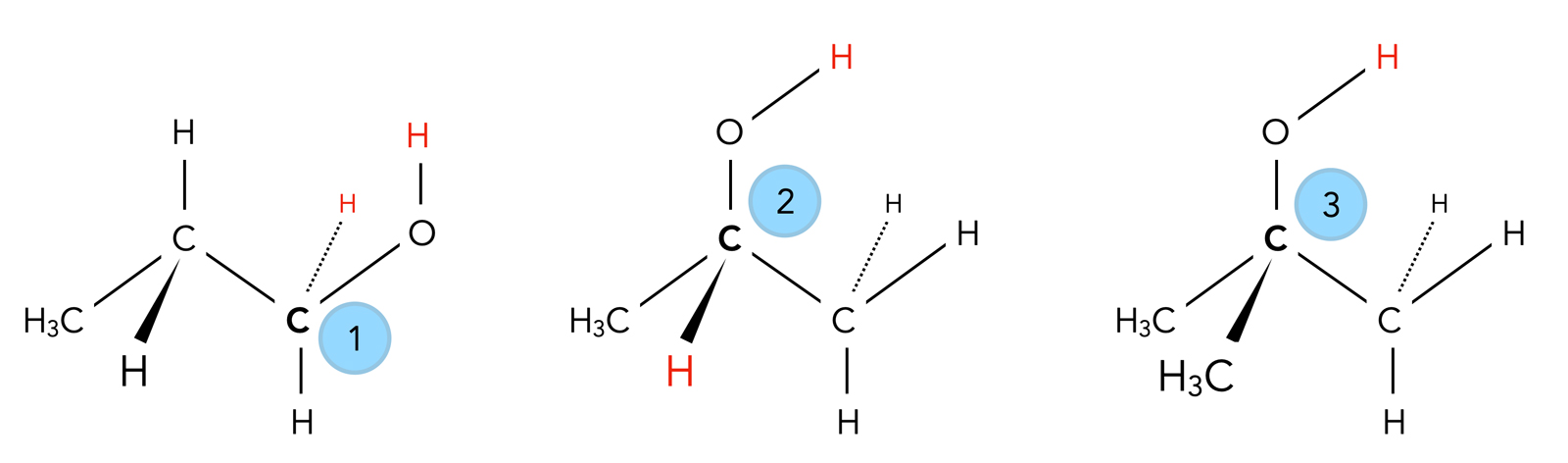
Primäre, sekundäre und tertiäre Alkohole im Vergleich, die für eine Oxidation zur Verfügung stehenden H-Atome sind rot hervorgehoben.
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei einem tertiären Alkohol (3) jedoch hat das betreffende C-Atom überhaupt kein H-Atom mehr, sondern ist mit drei anderen C-Atomen und der OH-Gruppe verbunden. Eine Oxidation durch Entzug von 2 H (= 2 H+ + 2 e-) ist hier also nicht möglich.
Oxidationsprodukte von Alkoholen
Das Oxidationsprodukt eines primären Alkohols ist ein Aldehyd, oxidiert man einen sekundären Alkohol, erhält man ein Keton. Das Kohlenstoffgerüst bleibt dabei erhalten. Tertiäre Alkohole können nicht oxidiert werden, ohne das Kohlenstoffgerüst zu zerstören.
Seitenanfang -
Alkohol-Oxidation -
Carbonylgruppe -
Nachweis -
Weitere Aspekte