Allgemeines EF
Die Carbonsäuren sind eine wichtige Stoffklasse der Organischen Chemie. Carbonsäuren sind Kohlenwasserstoffe, die eine Carboxy-Gruppe COOH besitzen. Die wohl bekannteste Carbonsäure ist die Essigsäure, die mit wissenschaftlichem Namen Ethansäure heißt.
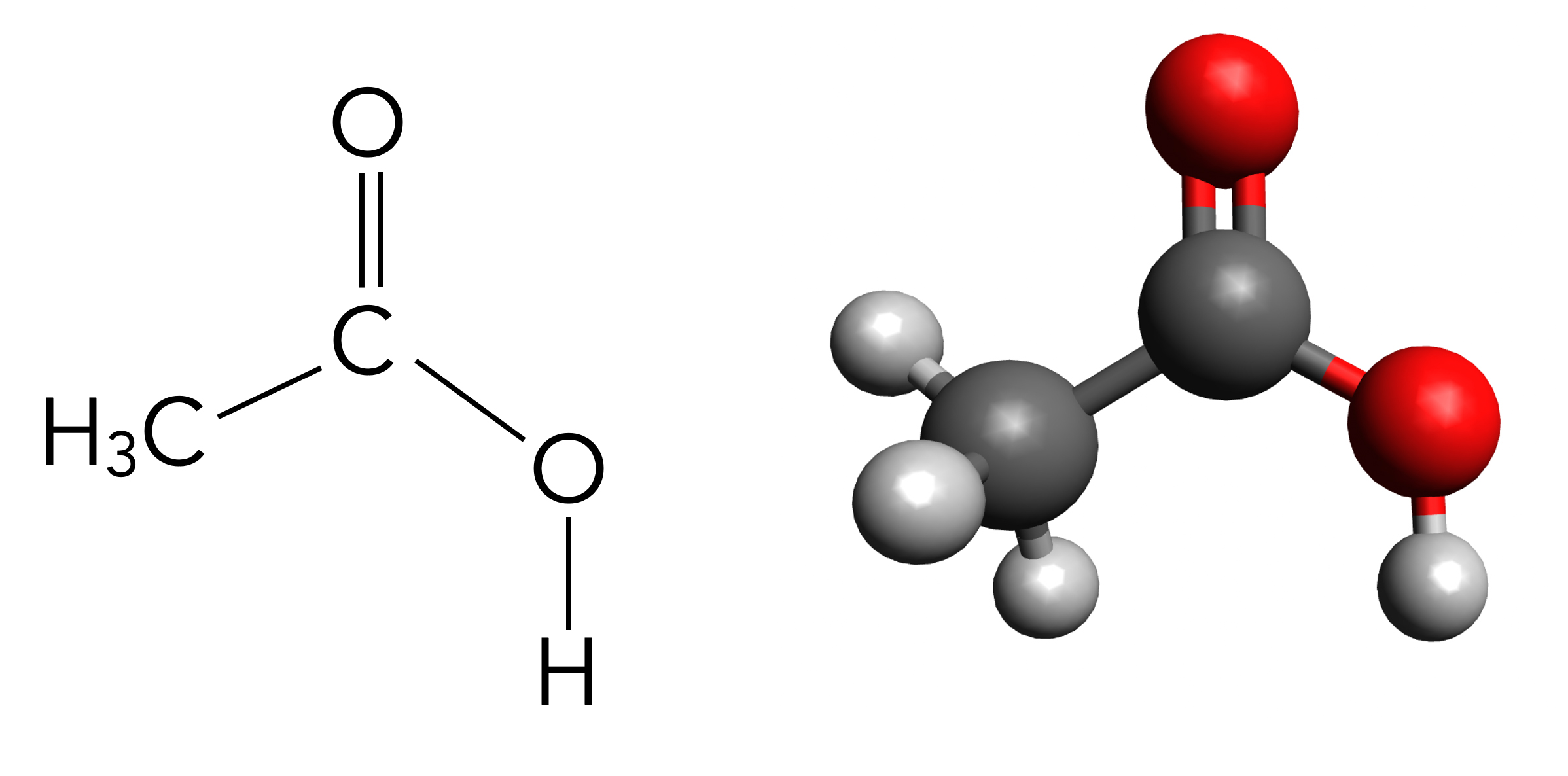 Strukturformel der Essigsäure bzw. Ethansäure
Strukturformel der Essigsäure bzw. Ethansäure
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Eine noch einfachere Carbonsäure als die Essigsäure ist die Ameisensäure H-COOH. H-COOH. Der IUPAC-Name dieser Säure ist Methansäure, weil sie sich vom Kohlenwasserstoff Methan ableitet.
Die Carboxy-Gruppe bedingt den Säurecharakter EF, Q1
Die Carboxy-Gruppe ist verantwortlich für den sauren Charakter der Carbonsäuren, denn die OH-Gruppe in der Carboxygruppe kann ihr H-Atom als Proton H+ abgeben. Übrig bleibt dann der Säure-Rest mit der Carboxylat-Gruppe COO-.

Carbonsäuren als Protonendonatoren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sieht man, wie die COOH-Gruppe eines Essigsäure-Moleküls ihr Wasserstoff-Atom als Proton abgibt, zurück bleibt das Acetat-Ion. Der gebogene rote Pfeil in dem Bild deutet das Umklappen des blau gekennzeichneten Elektronenpaars der O-H-Bindung an.
An dem Doppelpfeil kann man erkennen, dass es sich bei der Protonenabgabe um eine Gleichgewichtsreaktion handelt. In wässriger Lösung liegt der weitaus größte Teil der Essigsäure als Molekül CH3-COOH vor, neu ein kleiner Teil der Essigsäure-Moleküle hat sein Proton abgegeben und liegt als Anion CH3-COO- vor. Das Gleichgewicht dieser Protolyse liegt also weit auf der linken Seite, und damit gehören Essigsäure, Ameisensäure und die meisten anderen Carbonsäuren zu den sogenannten mittelstarken bis schwachen Säuren.
Die Säure-Anionen R-COO- sind daher mittelstarke bis starke Basen, da sie sehr leicht wieder ein Proton aufnehmen.
Wenn Sie noch Nachholbedarf zum Thema "Starke und schwache Säuren" haben, sollten Sie diese Abteilung der Chemie-Seiten besuchen. Hier wird alles erklärt, auch was man unter dem pKS-Wert versteht und wie man ihn aus dem pH-Wert einer Säure berechnet, wenn deren Konzentration bekannt ist.
Auf diesen Seiten erfahren Sie weitere Einzelheiten zum Thema. Hier wird auch die Stärke verschiedener Carbonsäuren verglichen und begründet. Allerdings sollten Sie vom Thema "Säurestärke" Ahnung haben und wissen, was man unter dem pKS-Wert versteht. Falls nicht, sollten Sie dem oberen Querverweis (starke und schwache Säuren) folgen.
Carbonsäuren sind Oxidationsprodukte von Aldehyden EF
Im Mittelstufen-Unterricht haben Sie vielleicht schon gelernt, dass Carbonsäuren aus Aldehyden entstehen. Hier sehen wir ein Beispiel für eine solche Oxidation:

Oxidation eines Aldehyds
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei dem Aldehyd handelt es sich um Ethanal, auch als Acetaldehyd bekannt. Durch Oxidation des Aldehyds erhalten wir die Ethansäure bzw. Essigsäure.
Der Oxidationsbegriff
An dieser Stelle sollten wir vielleicht noch einmal den Begriff "Oxidation" besprechen. Es gibt drei Definitionen dies Begriffs "Oxidation", die erste haben Sie in der Klasse 7 oder 8 gelernt, die zweite in der Klasse 9 oder 10, und die dritte in der Klasse 10 oder der Stufe EF, also in der Oberstufe.
Oxidation in der Klasse 7 oder 8:
- Unter einer Oxidation versteht man die Aufnahme von Sauerstoff
Oxidation in der Klasse 9 oder 10:
- Unter einer Oxidation versteht man die Abgabe von Wasserstoff
Oxidation in der Klasse 10 oder in der Stufe EF:
- Unter einer Oxidation versteht man die Abgabe von Elektronen
Bei der Oxidation des Aldehyds wird ein Sauerstoff-Atom aufgenommen, und wenn man sich die Reaktion etwas näher anschaut, bemerkt man auch, dass gleichzeitig zwei Elektronen abgegeben werden.
Dass genau zwei Elektronen abgegeben werden, kann man mit Hilfe der Oxidationszahlen feststellen. Das C-Atom des Aldehyds hat die Oxidationszahl +I, das C-Atom der Carbonsäure aber die Oxidationszahl +III - und das sind genau zwei Elektronen weniger.
Auf dieser Seite im Chemie-Lexikon wird genau erklärt, wie man die Oxidationszahl eines Atoms berechnet.
Oxidation von Alkoholen EF
Herstellung von Essig
Man kann Carbonsäuren nicht nur durch die Oxidation von Aldehyden herstellen, sondern auch durch die Oxidation von primären Alkoholen. Die Natur macht es uns vor. Essigsäure-Bakterien oxidieren nämlich Ethanol mit Hilfe von Luftsauerstoff zunächst zu Acetaldehyd (Ethanal) und dann in einem zweiten Schritt zu Essigsäure. Oxidationen sind in der Regel exotherme Reaktionen, und die Essigsäure-Bakterien nutzen die bei den beiden Oxidationsschritten freigesetzte Energie für ihren eigenen Stoffwechsel.
Diese Seite erläutert relativ ausführlich, wie die Oxidation eines Alkohols zu einem Aldehyd funktioniert.
Abbau von Alkohol
Ein zweites wichtiges Beispiel hat wieder mit Ethanol zu tun. Wenn man Ethanol getrunken hat, baut der Körper mit Hilfe des Enzyms Alkoholdehydrogenase (ADH) den Alkohol zu Ethanal ab. Ethanal wird dann durch andere Enzyme zu Essigsäure oxidiert, die für den Körper relativ unschädlich ist. Ethanal dagegen ist giftig und verursacht den sogenannten "Kater", also Übelkeit, starke Kopfschmerzen und so weiter.
Carbonsäuren im Alltag EF
Dieses Thema ist für die Klasse 10 und die Stufe EF ein wichtiges Thema, eine Auflistung aller Carbonsäuren und ihrer Bedeutung würde hier allerdings zu weit führen, daher wurde das Thema auf eine eigene Seite ausgelagert:
Auf dieser Seite finden Sie eine Auflistung der meisten Carbonsäuren und Hydroxycarbonsäuren mit ein, zwei, drei oder vier C-Atomen.
In der Klasse 10 oder der Stufe EF reicht es völlig aus, wenn Sie die für den Alltag wichtigsten Carbonsäuren kennen, nämlich:
- Ameisensäure (ein C-Atom mit einer COOH-Gruppe)
- Essigsäure (zwei C-Atome mit einer COOH-Gruppe)
- Oxalsäure (zwei C-Atome mit zwei COOH-Gruppen)
- Propionsäure (drei C-Atome mit einer COOH-Gruppe)
- Milchsäure (drei C-Atome mit einer COOH-Gruppe und einer OH-Gruppe)
- Buttersäure (vier C-Atome mit einer COOH-Gruppe)
- Äpfelsäure (vier C-Atome mit zwei COOH-Gruppen und einer OH-Gruppe)
- Weinsäure (vier C-Atome mit zwei COOH-Gruppen und zwei OH-Gruppen)
Reaktionen der Carbonsäuren Q1
Reaktionen der Carbonsäuren sind ein wichtiges Thema vor allem für die Stufen Q1 und Q2. Für Schüler(innen) der Stufe EF bzw. Klasse 10 reicht es eigentlich, wenn Sie wissen, dass Carbonsäuren mit Alkoholen Ester bilden und dass diese Ester wichtige Geruchs- und Geschmacksstoffe sind (natürlich nicht alle Ester, manche davon sind auch hochgiftig).
Auf dieser Folgeseite finden Sie die wichtigsten Reaktionen der Carbonsäuren. Diese Seite richtet sich vor allem an Schüler(innen) der Qualifikationsphase.
Eine weitere Seite zu den Reaktionen der Carbonsäuren. Diese Seite richtet sich an Studienanfänger(innen) der Fächer Chemie, Biologie etc.
Seitenanfang -
Weiter mit
den Reaktionen der Carbonsäuren ...