Reaktion als Säure Q1
Bereits auf der Einleitungsseite zum Thema "Carbonsäuren" haben wir uns kurz mit dem Säure-Base-Verhalten von Essigsäure und anderen Carbonsäuren beschäftigt. Auf dieser Seite wollen wir dieses wichtige Thema noch etwas vertiefen.
Die Carboxy-Gruppe oder kurz COOH-Gruppe ist in der Lage, ein Proton abzugeben. Alle Carbonsäuren sind daher Brönsted-Säuren.
Betrachten wir einmal die Säurestärken verschiedener Carbonsäuren[3].
| Säure | pKS-Wert |
| Methansäure (Ameisensäure) | 3,77 |
| Ethansäure (Essigsäure) | 4,76 |
| Propansäure | 4,87 |
| Butansäure (Buttersäure) | 4,82 |
| Pentansäure (Valeriansäure) | 4,84 |
Wie es aussieht, ist Methansäure die stärkste Carbonsäure und Ethansäure die zweitstärkste. Die folgenden Glieder der homologen Reihe der Monocarbonsäuren unterscheiden sich nicht mehr wesentlich in ihrer Säurestärke.
Außerdem nimmt die Wasserlöslichkeit der Carbonsäuren mit jedem zusätzlichen C-Atom ab, so dass der Säurecharakter dann sowieso keine Rolle mehr spielt.
Eine Erklärung für die abnehmende Säurestärke der längeren Carbonsäuren liegt in dem +I-Effekt der Alkyl-Gruppen. Alkyl-Gruppen "schieben" Elektronen von sich weg, und je länger die Alkyl-Gruppe einer Carbonsäure, desto größer wird die Elektronendichte der COOH-Gruppe. Je größer aber die Elektronendichte der COOH-Gruppe, desto stärker sind die H-Atome an die COOH-Gruppe gebunden und werden um so schlechter als Protonen abgegeben.
Wenn Sie noch Nachholfbedarf zum Thema "Starke und schwache Säuren" haben, sollten Sie diese Abteilung der Chemie-Seiten besuchen. Hier wird alles erklärt, auch was man unter dem pKS-Wert versteht und wie man ihn aus dem pH-Wert einer Säure berechnet, wenn deren Konzentration bekannt ist.
Ethansäure und Ethanol im Vergleich
Vergleichen wir einmal die Ethansäure mit dem Ethanol. Auch Ethanol hat eine OH-Gruppe, kann also ein H-Atom als Proton abgeben und damit als Säure wirken. Gibt man beispielsweise ein Stück Natrium in eine Petrischale mit Ethanol, setzt eine heftige Reaktion ein, bei der sich Wasserstoff bildet. Zurück bleibt dann das Salz Natriumethanolat CH3CH2ONa, ein weiß-gelber Feststoff. Diese Verbindung enthält das Ethanolat-Ion CH3CH2O-, das die korrespondierende Base des Ethanols CH3CH2OH ist.
Ethanol ist allerdings eine extrem schwache Säure. Der pKS-Wert von Ethanol liegt bei 10-16. Die Säurestärke von Essigsäure ist also viel höher als die von Ethanol.
Kleine Rechenaufgabe
Wie viel mal saurer ist nun die Essigsäure im Vergleich zum Ethanol?
Wir recherchieren die beiden pKS-Werte.
Essigsäure: 4,756
Ethanol: 16 (gerundet)
Die Differenz beträgt also 11,244. Der pKS-Wert ist der negative dekadische Logarithmus der Säurekonstante KS, also der Gleichgewichtskonstante der Protolyse-Reaktion. Daher kann man sagen, dass Essigsäure eine rund 1011 mal stärkere Säure ist als Ethanol, also hundert Milliarden mal saurer.
Der Grund für die größere Säurestärke kann nur das zusätzliche Sauerstoff-Atom in der Carboxy-Gruppe sein. Um zu verstehen, warum die Carboxy-Gruppe ihr Proton viel leichter abgibt als eine einfache Hydroxy-Gruppe, müssen wir mit dem Konzept der Mesomerie-Stabilisierung vertraut sein. Falls Sie das noch nicht sind, finden Sie die notwendigen Informationen in dem folgenden Kasten.
Mesomerie-Stabilisierung des R-COO--Ions
Betrachten wir einmal eine Zeichnung des Carboxylat-Ions:
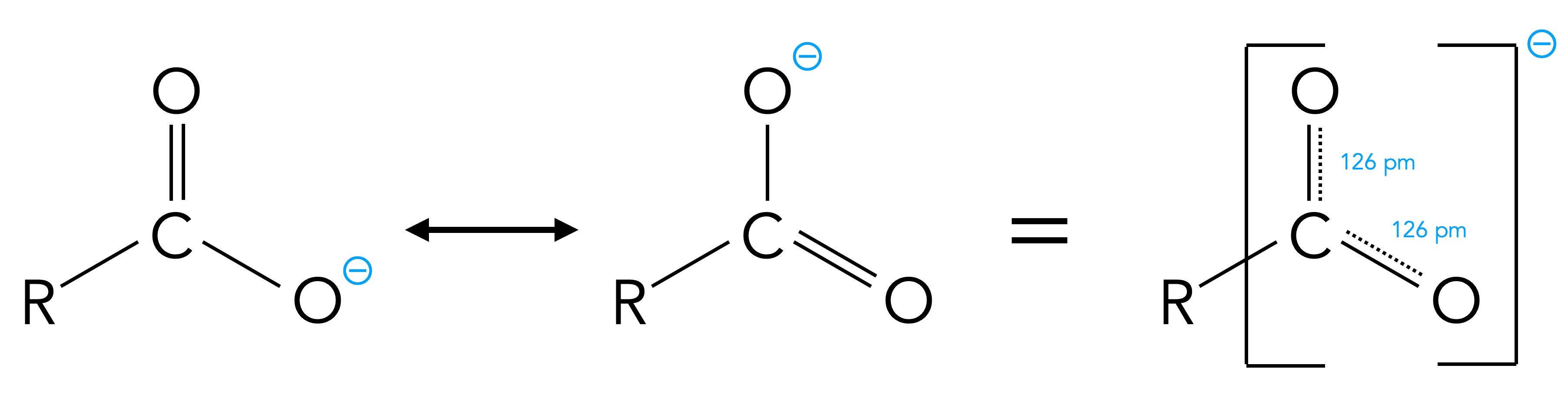
Das Carboxylat-Ion hat zwei Grenzstrukturen
Autor: Ulrich Helmich 2018, Lizenz: Public domain.
Das Carboxylat-Ion R-COO- kann in zwei verschiedenen Grenzstrukturen vorkommen. Die "wahre" Struktur dieses Ions liegt irgendwo zwischen diesen beiden Strukturen und kann nicht anschaulich dargestellt werden. Je mehr Grenzstrukturen von einem Teilchen (Molekül oder Ion) existieren, desto stabilier ist dieses Teilchen. Das Carboxylat-Ion R-COO- ist wegen seiner zwei Grenzstrukturen also stabiler als die Carbonsäure R-COOH, von der nur eine Struktur existiert.
Diese Art der Stabilisierung eines Ions oder Moleküls bezeichnet man auch als Mesomerie-Stabilisierung oder +M-Effekt.
Wegen dieser Mesomeriestabilisierung des R-COO--Ions kann das H-Atom der Carboxygruppe leicht abgegeben werden, die Bildung des Carboxylat-Ions ist energetisch sehr günstig[1].
Gibt ein Alkohol ein Proton ab, so entsteht ein Alkoholat-Ion mit einem negativ geladenem O-Atom. Für dieses Alkoholat-Ion gibt es aber nur eine Struktur, keine zwei oder gar drei Grenzstrukturen.
Das Alkoholat-Ion ist also nicht energetisch günstiger als das Alkohol-Molekül. Aus diesem Grund wird ein Alkohol also nur dann ein Proton abgeben, wenn eine wirklich extrem starke Base anwesend ist, während bei Essigsäure und anderen Carbonsäuren bereits die Anwesenheit von Wasser-Molekülen, also relativ schwachen Basen, ausreicht, um Protonen abzugeben.
Falls Sie vorhaben, Chemie als Abiturfach zu wählen, sollten Sie sich den folgenden Kasten mit einer alten Abituraufgabe näher ansehen. Natürlich können solche Aufgaben auch in einer normalen Chemie-Klausur vorkommen.
Abituraufgabe 2013
In einer Abituraufgabe aus dem Jahre 2013 (NRW) wurde folgende Teilaufgabe gestellt:
"Erklären Sie die unterschiedlichen pKS-Werte der Malein- und Fumarsäure anhand der Molekülstrukturen".
| pKS-Werte | Fumarsäure | Maleinsäure |
| erster pKS-Wert | 3,0 | 1,9 |
| zweiter pKS-Wert | 4,5 | 6,5 |
Den Schüler(innen) wurde dazu eine Abbildung wie die folgende zur Verfügung gestellt:
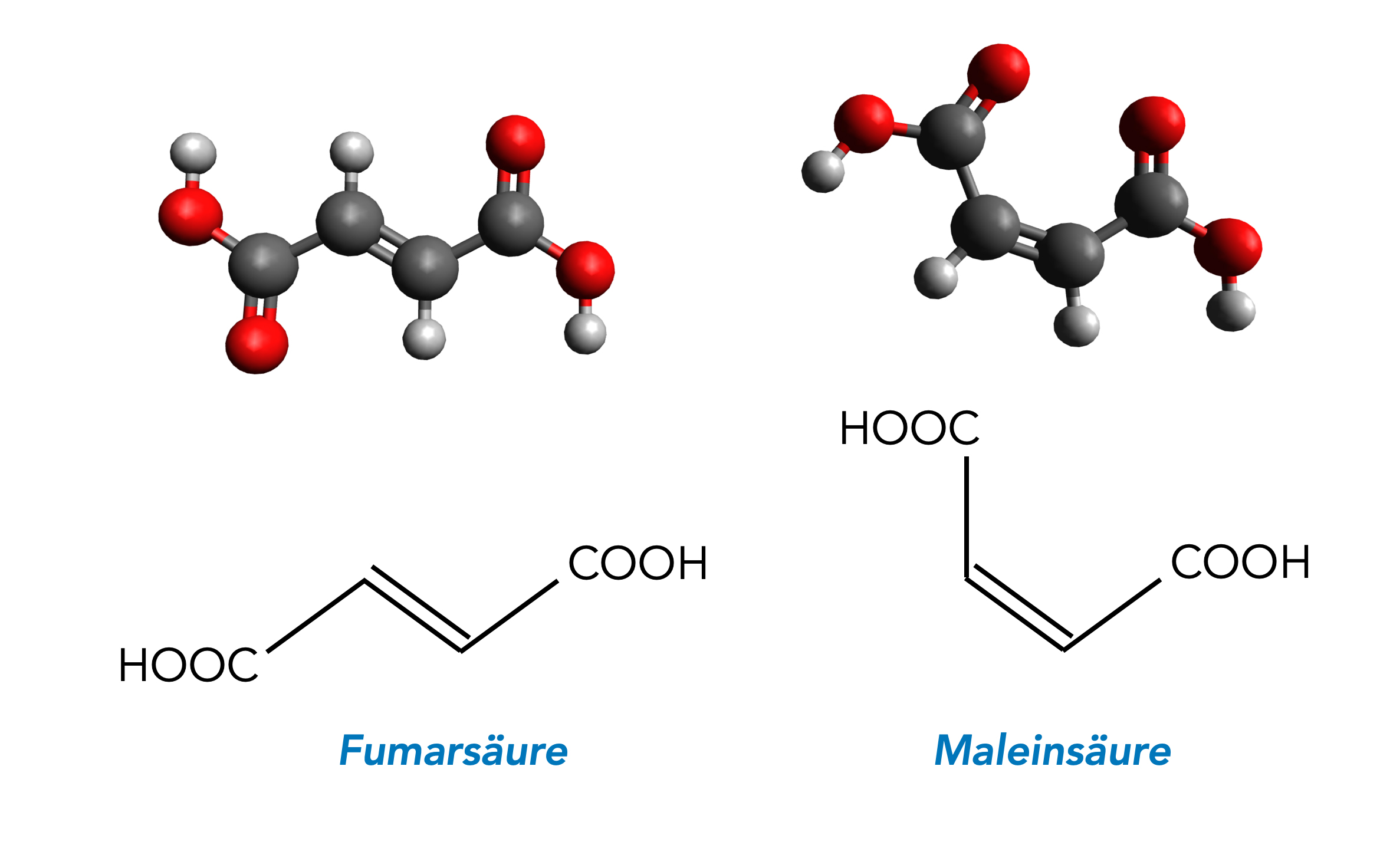
Fumarsäure und Maleinsäure
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wenn Sie an der Lösung dieser Aufgabe interessiert sind, gehen Sie auf die folgende Seite.
Salze der Carbonsäuren
Gibt man eine wasserlösliche Carbonsäure mit einer Lauge zusammen, so bilden sich Carbonsäuresalze. Aus Essigsäure und Natronlauge beispielsweise bildet sich Natriumacetat, aus Kalilauge und Ameisensäure entsteht Kaliumformiat.
Namen der Säurereste
Die Namen der Säurereste stehen oft in keiner Beziehung zu den Trivialnamen oder zu den IUPAC-Namen der entsprechenden Säure. Daher hier eine kleine Tabelle mit den wichtigsten Säurerest-Namen.
| Säure | Name des Restes |
| Methansäure (Ameisensäure) | Formiat |
| Ethansäure (Essigsäure) | Acetat |
| Propansäure | Propionat |
| Butansäure (Buttersäure) | Butyrat |
| Pentansäure (Valeriansäure) | Valerat |
Weiterführende Seiten
Wenn Sie sich näher über dieses Thema informieren wollen, sollten Sie sich diese Seite im Chemie-Lexikon anschauen.
Meistens denkt man gar nicht daran, aber die COOH-Gruppe kann auch ein Proton aufnehmen und wirkt damit als Base, und dass das Carboxylat-Ion R-COO- eine Base ist, sollte wohl jedem und jeder klar sein. Weitere Informationen dazu auf dieser Lexikon-Seite.
Diese Seite wurde für Studienanfänger(innen) der Fächer Chemie, Biologie, Medizin etc. geschrieben. Hier erfahren Sie mehr über das Säure-Base-Verhalten der Carbonsäuren. Für wissbegierige Schüler(innen) der gymnasialen Oberstufe könnten diese Seiten vielleicht auch interessant sein, sie gehen aber weit über die Abitur-Anforderungen hinaus.
Quellen:
- Morrison, Boyd, Organic Chemistry, 7th Edition 2011
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel zu den einzelnen Säuren
- Chemgapedia, Artikel "Reaktion von Carbonsäuren"
Seitenanfang -
Weiter mit der Substitution der OH-Gruppe ...