Die Alkene sind eine wichtige Stoffgruppe der Organischen Chemie. Es handelt sich um Kohlenwasserstoffe, die eine C=C-Doppelbindung enthalten. Kohlenwasserstoffe mit zwei Doppelbindungen werden auch als Diene bezeichnet, Kohlenwasserstoffe mit drei Doppelbindungen als Triene und so weiter.
Die C=C-Doppelbindung wird in manchen Schulbüchern (zum Beispiel Schroedel, Chemie heute SI) auch als C=C-Zweifachbindung bezeichnet. Ich werde in meinen Ausführungen jedoch beim Begriff C=C-Doppelbindung bleiben.
Alkene bilden eine homologe Reihe
Genau wie auch die Alkane bilden die Alkene eine homologe Reihe. Wer von Ihnen mit diesem Begriff schon etwas anfangen kann, kann den folgenden Kasten überspringen.
Homologe Reihe
Eine homologe Reihe besteht aus einer Reihe von Verbindungen, bei denen jede Verbindung der Reihe eine zusätzliche Methylengruppe (-CH2-) im Vergleich zur vorherigen Verbindung enthält. Daher ist es möglich, die Verbindungen einer homologen Reihe durch eine gemeinsame Summenformel zu charakterisieren. Bei den Alkanen lautet diese gemeinsame Summenformel beispielsweise CnH2n+2, bei den Alkenen CnH2n. Die sechste Verbindung der Alkanreihe (n=6) hat dann die Summenformel C6H14, die entsprechende Verbindung der Alkenreihe die Summenformel C6H12.
Dieses "Wachsen" innerhalb der homologen Reihe führt dann zu einer schrittweisen Zunahme der Molekülmasse und damit verbunden zu einer regelmäßigen Änderung physikalischer Eigenschaften. Bei den Alkenen nehmen beispielsweise die Schmelzpunkte, die Siedepunkte und die Dichten mit jeder neuen CH2-Gruppe kontinuierlich zu. Bei den Alkoholen nehmen diese Eigenschaften ebenfalls zu, aber die Wasserlöslichkeit nimmt mit der wachsenden Kohlenstoffkette ab.
Der Begriff "homologe Reihe" ist schon sehr alt, er wurde 1843 von Charles Frédéric Gerhardt geprägt. Später wurde dann von Jean Baptiste Dumas experimentell nachgewiesen, dass bestimmte physikalische Eigenschaften innerhalb einer solchen homologen Reihe tatsächlich mehr oder weniger kontinuierlich zunehmen oder abnehmen (Siedepunkte, Schmelzpunkte, Viskosität und Dichten nehmen normalerweise zu, während die Wasserlöslichkeit oft abnimmt).
Physikalische Eigenschaften
Über die physikalischen Eigenschaften der Alkene ist nicht viel zu sagen, weitgehend ähneln sie denen der Alkane.
Die Moleküle werden nur durch ganz schwache intermolekulare Kräfte (London-Wechselwirkungen) zusammengehalten, und das erklärt dann die relativ niedrigen Schmelzpunkte, Siedepunkte und Dichten. Weder sind die Moleküle nennenswerte Dipole, noch können sie Wasserstoffbrücken-Bindungen ausbilden, und das wiederum erklärt die absolut geringe Wasserlöslichkeit der Alkene.
Auf den Seiten der Studienvorbereitung OC habe ich auch einen längeren Abschnitt zu den physikalischen Eigenschaften der Alkene geschrieben. Wenn Sie sich das zutrauen, können Sie diese Seite natürlich gerne lesen und dann ihren Chemielehrer damit beeindrucken.
Chemische Eigenschaften
Viel interessanter als die physikalischen Eigenschaften der Alkene sind die chemische Eigenschaften, also die Reaktionsfähigkeit.
Während die Alkane - abgesehen von der Halogenierung und Oxidation - weitgehend als "reaktionsträge" gelten, können Alkene deutlich mehr Reaktionen eingehen.
Der Grund für die höhere Reaktivität der Alkene ist die C=C-Doppelbindung im Molekül. Wenn Sie noch nicht wissen, wie eine solche C=C-Doppelbindung aufgebaut ist, lesen Sie sich doch bitte den folgenden Kasten durch.
C=C-Doppelbindung
Bei der C=C-Doppelbindung handelt es sich um zwei kovalente Bindungen, die die beiden C-Atome zusammenhalten. Eine dieser Bindungen ist eine normale Elektronenpaarbindung und ist daher recht stark. Die zweite Bindung dagegen ist eine schwache Bindung und kann daher leicht gespalten werden. Man bezeichnet die starke Bindung auch als sigma-Bindung, während man die schwächere Bindung pi-Bindung nennt.
So richtig kann man die Natur der C=C-Doppelbindung erst erkennen, wenn man das Orbitalmodell verstanden hat. Mit dem Kugelwolkenmodell kann man den unterschiedlichen Charakter die sigma- und der pi-Bindung nicht erklären. In der Stufe EF wird das Orbitalmodell allerdings noch nicht behandelt (außer in diesem einen GIDA-Film, wo es um Graphen und Nanotubes geht), daher müssen wir uns hier noch etwas mit dem Kugelwolkenmodell behelfen.
Die typische Reaktion der Alkene ist die Addition
Durch die beiden kovalenten Bindungen ist die Elektronendichte an der C=C-Doppelbindung sehr hoch. Das führt dazu, dass positive Teilchen wie zum Beispiel Protonen H+ leicht angezogen werden und sich dann an eines der beiden C-Atome setzen. Die schwache pi-Bindung löst sich dann auf, übrig bleibt nur noch die starke sigma-Bindung. Außerdem ist jetzt eines der beiden C-Atome positiv geladen, denn die positive Ladung des angekommenen Teilchens kann ja nicht einfach verschwinden. Diese positive Ladung des einen C-Atoms zieht nun ihrerseits negativ geladene Teilchen an.
Beispiel Addition von Wasser an Buten
Betrachten wir nun ein einfaches Beispiel für eine solche elektrophile Addition. Dieser Reaktionstyp heißt "elektrophile" Addition, weil elektronenliebende Teilchen, sogenannte Elektrophile, an die Doppelbindung addiert werden.
Wir lassen Wasser mit Propen reagieren:
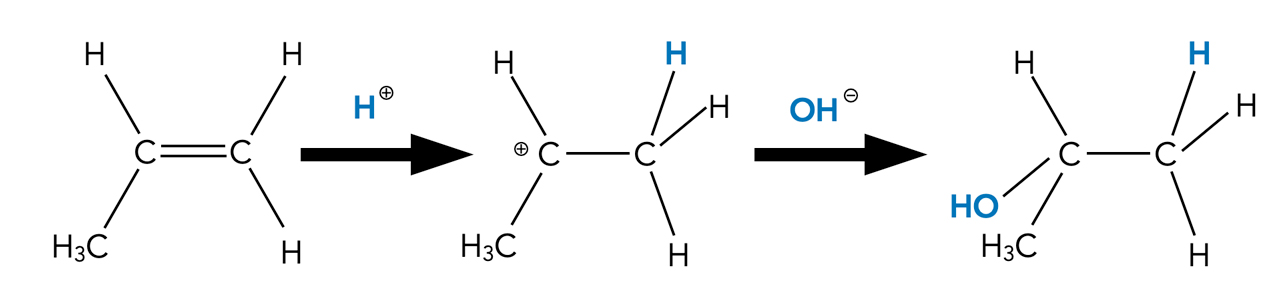
Addition von Wasser an die C=C-Doppelbindung von Propen
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Zunächst setzt sich das Elektrophil H+ an ein C-Atom der Doppelbindung. Die pi-Bindung löst sich auf, und das andere C-Atom übernimmt die positive Ladung. Es bildet sich als Zwischenprodukt ein sogenanntes Carbenium-Ion.
Eine negativ geladene Hydroxid-Gruppe OH- aus dem Wasser setzt sich nun an das positiv geladene C-Atom, und als Endprodukt dieser Reaktion ist ein Alkohol entstanden, nämlich 2-Propanol.
Alkene können viele andere elektrophile Additionsreaktionen eingehen, manche davon laufen auch etwas komplizierter ab als die Addition von Wasser. So können viele wichtige chemische Verbindungen hergestellt werden, nicht nur verschiedene Alkohole, sondern auch Halogenalkane, Stickstoff- und Schwefelverbindungen und mehr. Auch viele Kunststoffe werden aus Alkenen hergestellt, zum Beispiel Polyethylen (PE), Polypropylen (PP), Polystyrol (PS) und Polyvinylchlorid (PVC).
Die elektrophile Addition ist die typische Reaktion der Alkene. Die Addition von Wasser haben wir ja bereits auf dieser Seite kurz kennen gelernt. Auf den Seiten zur elektrophilen Addition wird dieser Reaktionsmechanismus ausführlich und in allen Einzelheiten für Schüler(innen) der Qualifikationsphase dargestellt.
Wer es gerne anspruchsvoller hat, geht einfach auf die entsprechende Seite in der Studienvorbereitung Organik, die sich an Studienanfänger(innen) der Fächer Chemie, Biologie, Medizin etc. richtet.
Der Vorteil der Alkene ist, dass sie leicht und preiswert aus Erdöl oder Erdgas gewonnen werden können, genauso wie die Alkane. Nur dass Alkane stärker "überredet" werden müssen, eine chemische Reaktion einzugehen.