Einfluss des Substrats
Das Substrat selbst hat einen entscheidenden Einfluss darauf, ob die Nucleophile Substitution nach dem SN1 oder nach dem SN2-Mechanismus abläuft. Betrachten wir dazu folgende Tabelle:
| Substrat | Geschwindigkeit der SN2 | Geschwindigkeit der SN1 |
| H3C-X | schnell | vernachlässigbar |
| R-CH2-X | schnell | langsam |
| R2-CH-X | gemäßigt | gemäßigt |
| R3C-X | langsam | schnell |
Dabei ist 'R' eine Alkyl-Gruppe und 'X' die Abgangsgruppe.
Methan-Derivate / primäre Substrate
Methan-Derivate wie CH3-Cl und primäre Substrate wie C2H5-Br reagieren laut Tabelle bevorzugt nach dem SN2-Mechanismus. Ein Hauptgrund hierfür ist die Tatsache, dass sich bei dem monomolekularem Reaktionsweg ein sehr instabiles Carbenium-Ion bilden müsste.
Ein zweiter Faktor ist die leichte Zugänglichkeit des Substrats für das angreifende Nucleophil. Bei sekundären und vor allem bei tertiären Substraten muss sich das angreifende Nucleophil um die manchmal großen Alkyl-Gruppen "herumarbeiten", um an das C-Atom mit dem Nucleofug zu gelangen. Bei Methan-Derivaten oder primären Substraten fällt dieser sterische Faktor weg.
Tertiäre Substrate
Hängt das Nucleofug an einem tertiären C-Atom, so geht seine heterolytische Abspaltung recht schnell, weil dabei ein tertiäres Carbenium-Ion entsteht, und diese gelten als besonders stabil. Daher reagieren tertiäre Substrate bevorzugt nach dem SN1-Mechanismus. Der SN2-Mechanismus ist dagegen erschwert, weil die Alkyl-Gruppen dem angreifenden Nucleophil oft im Weg sind (sterischer Effekt).
Sekundäre Substrate
Wenn das Nucleofug an einem sekundären C-Atom hängt, dann ist seine heterolytische Abspaltung nicht ganz so einfach wie bei einem tertiären Substrat, ist aber noch gut möglich. Der SN1-Weg ist daher kein Problem.
Andererseits sind die sterischen Hindernisse durch die Alkyl-Gruppen nicht ganz so stark wie bei tertiären Substraten, so dass auch der SN2-Weg einschlagen werden kann, allerdings nicht so gut wie bei primären Substrate.
Sekundäre Substrate können also beide Mechanismen einschlagen, aber beide Reaktionswege laufen dann eher mit mittlerer Geschwindigkeit ab.
Merke:
Einfluss des Substrats
Zwei Faktoren spielen hier eine Rolle: Die Stabilität der beim SN1-Mechanismus entstehenden Carbenium-Ionen, und die Zugänglichkeit des relevanten C-Atoms für das Nucleophil.
- Bei tertiären Substraten ist das Carbenium-Ion sehr stabil, während das Nucleophil nicht so gut angreifen kann, daher wird hier eher der SN1-Weg eingeschlagen.
- Bei primären Substraten ist die Bildung von Carbenium-Ionen schwer, während das Nucleophil gut angreifen kann, da keine Alkyl-Gruppen im Weg sind. Daher wird hier eher der SN2-Weg eingeschlagen.
- Bei sekundären Substraten sind beide Wege möglich, und andere Faktoren entscheiden dann, welcher Mechanismus bevorzugt wird.
Für Studierende habe ich eine vertiefende Seite zum Einfluss des Substrats geschrieben. Sie finden diese Seite in der Abteilung "Studienvorbereitung Organische Chemie".
Einfluss des Lösemittels
Lösemittel können polar oder unpolar sein.
Polare Lösemittel haben permanente Dipole oder können Wasserstoffbrücken-Bindungen mit gelösten Teilchen eingehen. Beispiele sind Wasser und Ethanol.
Unpolare Lösemittel haben keine permanenten Dipole und können keine Wasserstoffbrücken-Bindungen eingehen. Hexan ist ein Beispiel.
Für nucleophile Substitutionen sind polare Lösemittel besser geeignet, da Nucleophile stark polar sind und sich in unpolaren Lösemitteln wie Hexan nicht lösen. Polare Lösemittel stabilisieren Carbenium-Ionen (SN1) und pentavalente Übergangszustände (SN2) besser als unpolare.
Protische polare Lösemittel
Protische polare Lösemittel sind eine besondere Gruppe von polaren Lösemitteln. Ihre Moleküle sind Dipole und können Protonen abgeben, wodurch sie zu Brönsted-Säuren werden. Wasser und Ethanol sind bekannte protische Lösemittel.
Wenn man nach dem stärkeren Nucleophil fragt, dem Fluorid-Anion oder dem Iodid-Anion, antworten die meisten, dass Fluorid stärker ist. Das erscheint logisch, da Fluor aggressiv ist und Glas ätzt, während Iod harmlos ist und in Wundsalben verwendet wird.
Überraschenderweise ist das Iodid-Ion in Wasser oder Ethanol ein viel stärkeres Nucleophil als das Fluorid-Ion. Experimentell ist die Reihenfolge der Nucleophilie in protischen Lösemitteln:
I- > Br- > Cl- > F-
Um dieses überraschende Ergebnis zu verstehen, müssen wir uns mit dem Begriff der Ladungsdichte vertraut machen. Vergleichen wir Fluorid (F-) mit Iodid (I-).
Beide Ionen haben eine Ladung von -1, aber das Fluorid-Ion ist viel kleiner. Die negative Ladung ist also auf einem kleineren Raum verteilt, was zu einer höheren Ladungsdichte führt.
Die Solvathülle des Fluorid-Ions ist größer, da die Zahl der umhüllenden Teilchen mit der Ladungsdichte zunimmt. Diese große und relativ fest gebundene Solvathülle hindert das Fluorid-Ion daran, das organische Substrat bei der nucleophilen Substitution zu erreichen.
Die Solvathülle des Iodid-Ions ist kleiner und kann leichter entfernt werden. Daher ist die Wahrscheinlichkeit, dass ein "nacktes" Iod-Ion das Nucleofug verdrängt, größer. Iodid-Ionen sind daher stärkere Nucleophile als Fluorid-Ionen, insbesondere in polaren Lösemitteln, die Nucleophile solvatisieren können.
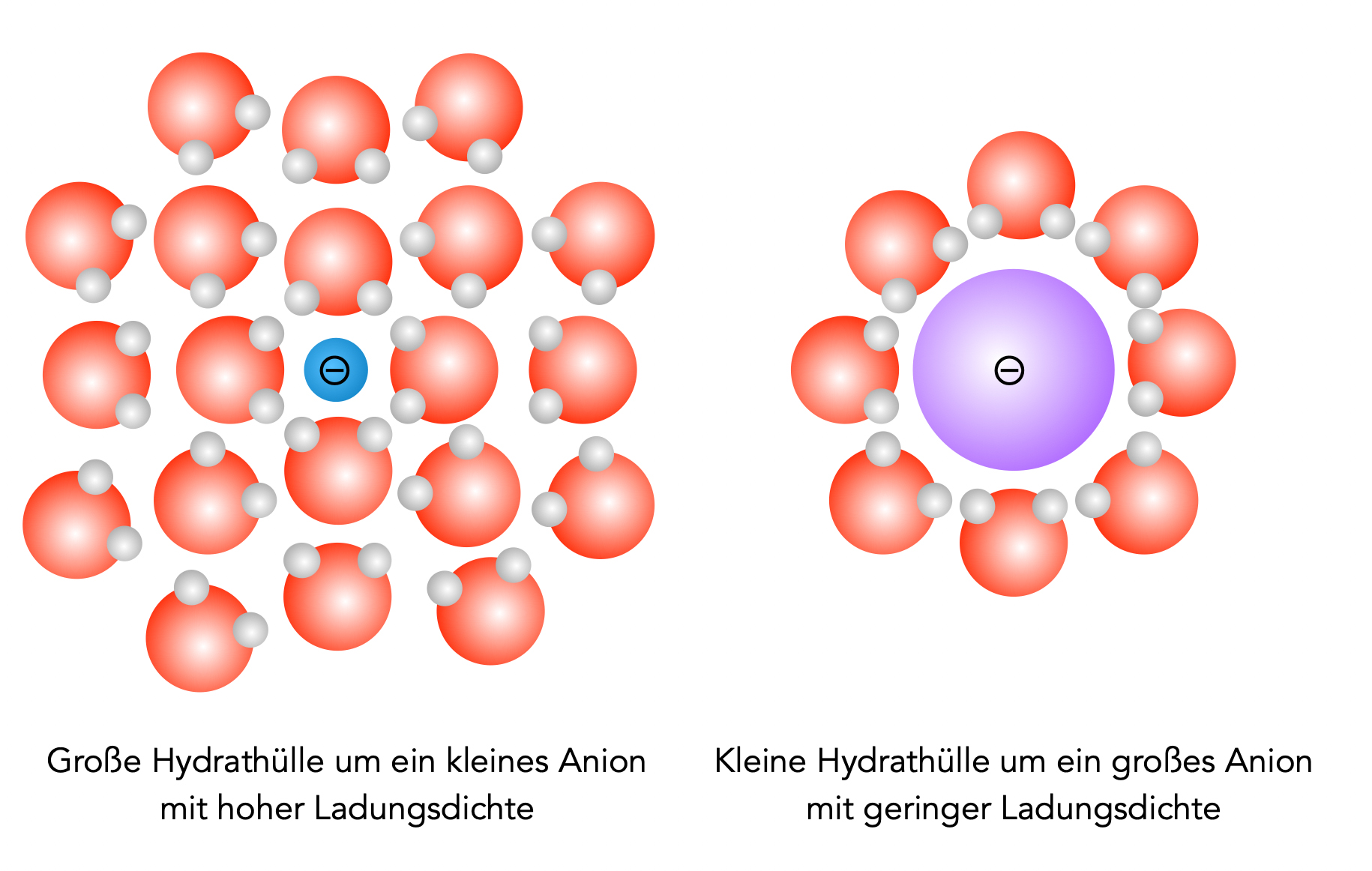
Hydrathüllen um kleine und große Anionen
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Aprotische polare Lösemittel
Nach dem, was in vorherigen Abschnitt gesagt wurde, kann man jetzt schlussfolgern, wie die Substitution in einem aprotischen, nur schwach polaren Lösemittel abläuft, das keine starke Solvathülle um das Nucleophil bildet.
Das "nackte" Nucleophil kann das organische Substrat effektiver angreifen als ein solvatisiertes, daher begünstigen aprotische Lösemittel die SN2-Reaktion. Allerdings muss das aprotische Lösemittel immer noch polar sein. In einem unpolaren Lösemittel wie Hexan laufen weder die SN1 noch die SN2 mit merklicher Geschwindigkeit ab.
Merke:
Lösemitteleinfluss
Protische polare Lösemittel (z. B. Wasser, Ethanol) solvatisieren Nucleophile stark und dämpfen so deren Reaktivität. Deshalb ist in protischen Lösemitteln das größere, aber weniger stark solvatisierte Iodid-Ion ein stärkeres Nucleophil als das kleine, jedoch stark solvatisierte Fluorid-Ion.
In aprotischen Lösemitteln ist die Nucleophilie umgekehrt, da die Nucleophile dort "nackt" vorliegen und das Substrat besser angreifen können. Hier kann das kleine Fluorid-Ion leichter als Nucleophil angreifen als das große Iodid-Ion.
Für Studierende habe ich eine weitaus ausführlichere Seite zum Einfluss des Lösemittels geschrieben.
Konzentration und Reaktivität des Nucleophils
Konzentration
Ist die Konzentration des Nucleophils recht klein, ist es eher unwahrscheinlich, dass ein Molekül des Nucleophils mit dem organischen Edukt zusammenstößt und die Abgangsgruppe aus dem Edukt verdrängt. Wahrscheinlicher ist dagegen ein spontaner Zerfall des organischen Edukts in ein Carbenium-Ion und die Abgangsgruppe. Niedrige Nucleophil-Konzentrationen begünstigen also den SN1-Mechanismus. Allerdings darf man dann keine hohe Produkt-Ausbeute erwarten.
Bei hoher Nucleophil-Konzentration steigt die Chance auf direkten Angriff – das fördert die SN2-Reaktion.
Reaktivität
Starke Nucleophile greifen das C-Atom an leichter und schneller an - typisch für SN2. Schwache Nucleophile müssen warten, bis sich das Edukt von selbst spaltet - typisch für SN1.
Große Ionen sind meist reaktiver, da sie leichter polarisierbar sind – das unterstützt den Übergangszustand bei SN2.
In protischen Lösungsmitteln gilt: je weiter links, desto stärker das Nucleophil:
SH- > I- > OH- > NH3 > Br- > Cl- > F- > H2O
Weitere Einzelheiten finden Sie auf dieser Seite für Studienanfänger.
Einfluss der Abgangsgruppe
Auch das Nucleofug, also die Abgangsgruppe des Substrats, hat einen wichtigen Einfluss auf den Weg der Nucleophilen Substitution.
Manche Gruppen (sogenannte Nucleofuge) lösen sich leicht vom C-Atom – andere nicht. Gut ist eine Austrittsgruppe dann, wenn dabei ein stabiles Anion entsteht. Ein Beispiel: Die SO3H-Gruppe. Das Anion ist mesomeriestabilisiert:
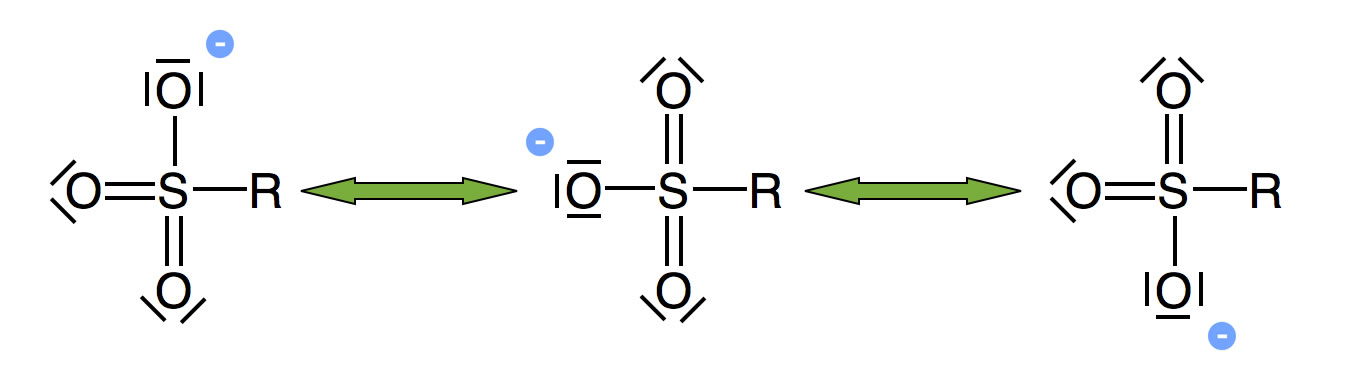
Mesomeriestabilisierung beim R-SO3--Ion
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Auch Iod ist eine gute Austrittsgruppe – Chlor ist dagegen eher
Die Reihenfolge der Halogen-Abgangsgruppen:
I- > Br- > Cl- > F-
Das entspricht auch ihrer Nucleophil-Stärke in Wasser oder Ethanol. Die OH-Gruppe ist eine schlechte Austrittsgruppe – aber durch Protonierung wird sie besser.
Ein Vergleichsversuch zeigt: Bei Mischung von Iodethan und Bromethan reagiert meist nur das Iodethan, weil Iod leichter abgespalten wird.
Auch das Lösungsmittel beeinflusst den Austritt. Wenn es zum Beispiel H-Brücken zum Nucleofug bildet, wird der Austritt gefördert und der Rückweg erschwert. Durch Protonierung können auch die schlechten Nucleofuge -OH und -OR in gute Nucleofuge umgewandelt werden.
Fluorid, SH-, SR-, Amino- oder Nitrogruppen sowie P-haltige Gruppen sind keine guten Nucleofuge.
Die Austrittsgruppe als Nucleophil
Nach der Reaktion liegt das Nucleofug als Anion in der Lösung. Es kann nun zurückreagieren, wenn es ein starkes Nucleophil ist. Beispiel: Iodid-Ionen greifen das Produkt wieder an.
Um die Rückreaktion zu verhindern, kann man Iodid-Ionen entfernen – zum Beispiel mit Ag+-Ionen. Dann entsteht schwer lösliches Silberiodid, und das Gleichgewicht der Reaktion wird zur Produktseite verschoben.
Merke:
Einfluss des Nucleofugs
Eine gute Austrittsgruppe (Nucleofug) verlässt das Molekül leicht und stabilisiert sich dabei selbst als Anion.
Gute Abgangsgruppen fördern sowohl SN1- als auch SN2-Reaktionen.
Typische gute Austrittsgruppen: I- > Br- > Cl- > F-).
Schlechte Gruppen wie -OH können durch Protonierung oder durch Bildung von H-Brücken mit dem Lösemittel in bessere Abgangsgruppen umgewandelt werden.
Manche Nucleofuge können als Nucleophile eine Rückreaktion eingehen, wenn sie starke Nucleophile sind. Solche Nucleofuge werden dann aus der Lösung entfernt, um eine Rückreaktion zu verhindern.
Hier finden Sie noch mehr Einzelheiten zum Thema.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.