Einfache Erklärung der Versuchsergebnisse
Eine Pufferlösung ist eine wässrige Lösung, die bei der Zugabe einer Säure bzw. Lauge ihren pH-Wert so gut wie nicht verändert.
Pufferlösungen bestehen meistens aus einer mittelstarken oder schwachen Säure wie Essigsäure, Kohlensäure, Phosphorsäure und einem Salz dieser Säure. In unserem Beispiel haben wir Essigsäure und Natriumacetat verwendet.
Gibt man nun eine Lauge zu der Pufferlösung, so werden die Hydroxid-Ionen der Lauge durch die Säure-Moleküle des Puffers abgefangen. Ein Teil der Säure-Moleküle gibt Protonen ab, die sich dann mit den Hydroxid-Ionen zu Wasser verbinden:

Die Wirkung der Lauge wird dadurch abgepuffert; der pH-Wert der Lösung verändert sich kaum. Gibt man weitere Lauge zu der Lösung, verschiebt sich das Gleichgewicht nach rechts; weitere Säure-Moleküle geben Protonen an die Hydroxid-Ionen ab, so dass sich deren Konzentration nur unwesentlich erhöht.
Gibt man nun Salzsäure in die Pufferlösung, so werden die Oxonium-Ionen der Salzsäure durch die Acetat-Ionen der Pufferlösung abgefangen bzw. abgepuffert:

Durch die Erhöhung der Oxoniumionen-Konzentration wird das Gleichgewicht der obigen Protolyse nach rechts verschoben, so dass c(H3O+) und damit der pH-Wert mehr oder weniger konstant bleibt.
pH-Wert einer Pufferlösung
Wenn wir bei der Herstellung unserers Acetatpuffers die gleichen Stoffmengen bzw. Konzentrationen von Essigsäure und Natriumacetat verwenden, ist die Berechnung des pH-Wertes dieser Pufferlösung sehr einfach.
Dazu schauen wir uns die Gleichung für die Säurekonstante an:
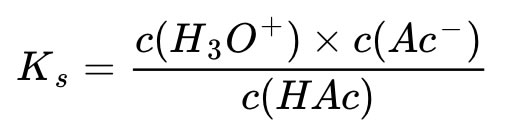
Nun gilt aber c(Ac-) = c(HAc), da wir von beiden Stoffen die gleiche Stoffmenge in dem selben Lösungsmittel gelöst haben. Damit vereinfacht sich die Gleichung zu:
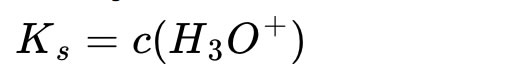
oder:
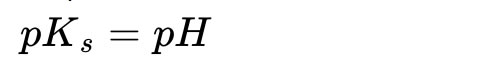
Der pH-Wert entspricht also genau dem pKS-Wert der schwachen Säure.
Wenn man den pH-Wert des Puffers leicht verändern will, so wendet man die Henderson-Hasselbalch-Gleichung an (siehe Spezialseite). Das Verhältnis aus Säure und Säurerest bestimmt dann den pH-Wert.
Pufferbereich und Pufferkapazität
Schauen wir uns dazu das folgende Bild an:
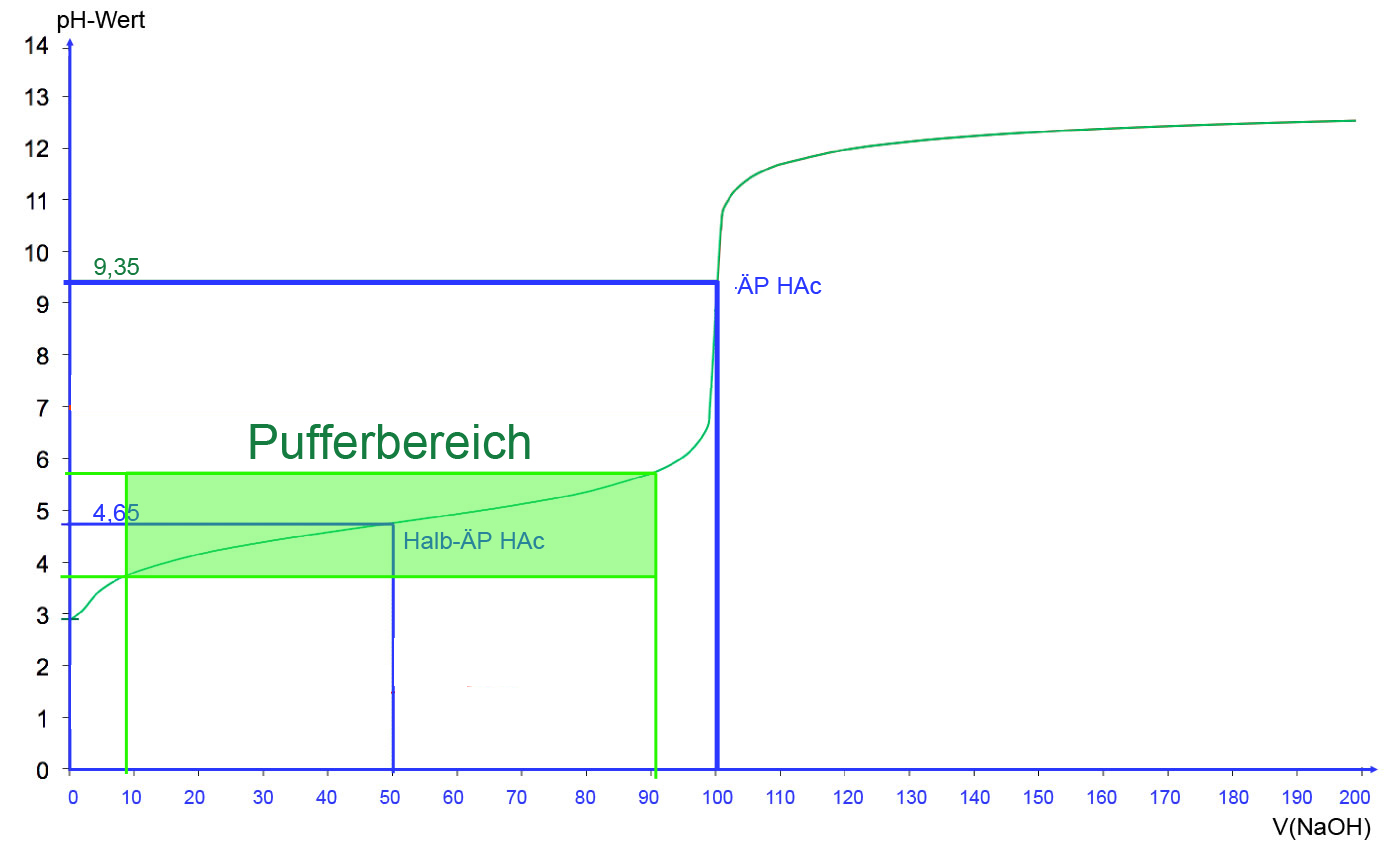
Wir sehen hier die Titrationskurve von Essigsäure mit Natronlauge. Am Halbäquivalenzpunkt entspricht der pH-Wert dem pKS-Wert der Essigsäure von 4,65 (bzw. 4,75 in manchen Büchern).
Als Pufferbereich bezeichnet man nun den Bereich der Titrationskurve, in dem der pH-Wert der Lösung maximal eine Einheit unter bzw. über diesem Wert liegt. Die Pufferkapazität ist die Menge an Lauge bzw. Säure, die eine Pufferlösung aufnehmen kann, ohne dass der pH-Wert den Pufferbereich verlässt. Die Pufferkapazität ist wiederum abhängig von den Konzentrationen der gelösten Säure und des gelösten Salzes.
Das ist ja eigentlich logisch: Wenn man nur Spuren von Essigsäure und Natriumacetat in 10 Liter Wasser auflöst, reichen schon wenige Milliliter Säure oder Lauge aus, um den pH-Wert stark zu verändern, denn eine solche Lösung unterscheidet sich kaum noch von reinem Wasser.
Andererseits darf eine Pufferlösung auch nicht zu konzentriert sein. Zwar ist dann die Pufferkapazität enorm, aber aufgrund der hohen Säure- bzw. Salzkonzentration treten oft unerwünschte Nebeneffekt auf, zum Beispiel steigt der osmotische Wert einer solchen Lösung so stark an, dass lebende Zellen beschädigt werden (Plasmolyse).