Versuch
Schwache Säuren, bei denen das Protolysegleichgewicht weit auf der linken Seite liegt, lassen sich ebenfalls mit einer Lauge titrieren. Allerdings verläuft die Titration hier anderes, da stets nur ein geringer Teil der Säure-Moleküle dissoziiert ist. In dem Versuch 12 wollen wir die Titrationskurve der Reaktion einer schwachen Säure mit NaOH erstellen.
Versuch 12
Titration einer schwachen Säure
Durchführung:
Titrieren Sie 100 ml Essigsäure der Konzentration c(CH3COOH) = 0,1 mol/l, der einige Tropfen Universalindikator zugegeben wurden, mit Natronlauge der Konzentration c(NaOH) = 0,1 mol/l.
Lassen Sie die Natronlauge zunächst in Portionen von je 10 ml zufließen und notieren Sie anschließend das Volumen der verbrauchten Natronlauge sowie den pH-Wert (pH-Messgerät).
Wenn Sie sich dem Äquivalenzpunkt nähern, also nach ca. 90 ml Natronlauge, verkleinern Sie die Portionsgröße der Natronlauge auf 1 ml. Notieren Sie weiterhin V(NaOH) und den pH-Wert der Lösung.
Wenn Sie 110 ml Natronlauge zugegeben haben, erhöhen Sie die Portionsgröße wieder auf 10 ml. Wenn Sie insgesamt 200 ml NaOH dazugegeben haben, beenden Sie den Versuch.
Stellen Sie die Wertpaare V(NaOH) / pH-Wert anschließend durch eine Kurve dar.
Beobachtungen:
Die grüne Kurve stellt die ermittelte Titrationskurve dar. Die rote Kurve zeigt zum Vergleich die Titration von Salzsäure mit Natronlauge (Konzentration jeweils 0,1 mol/l).
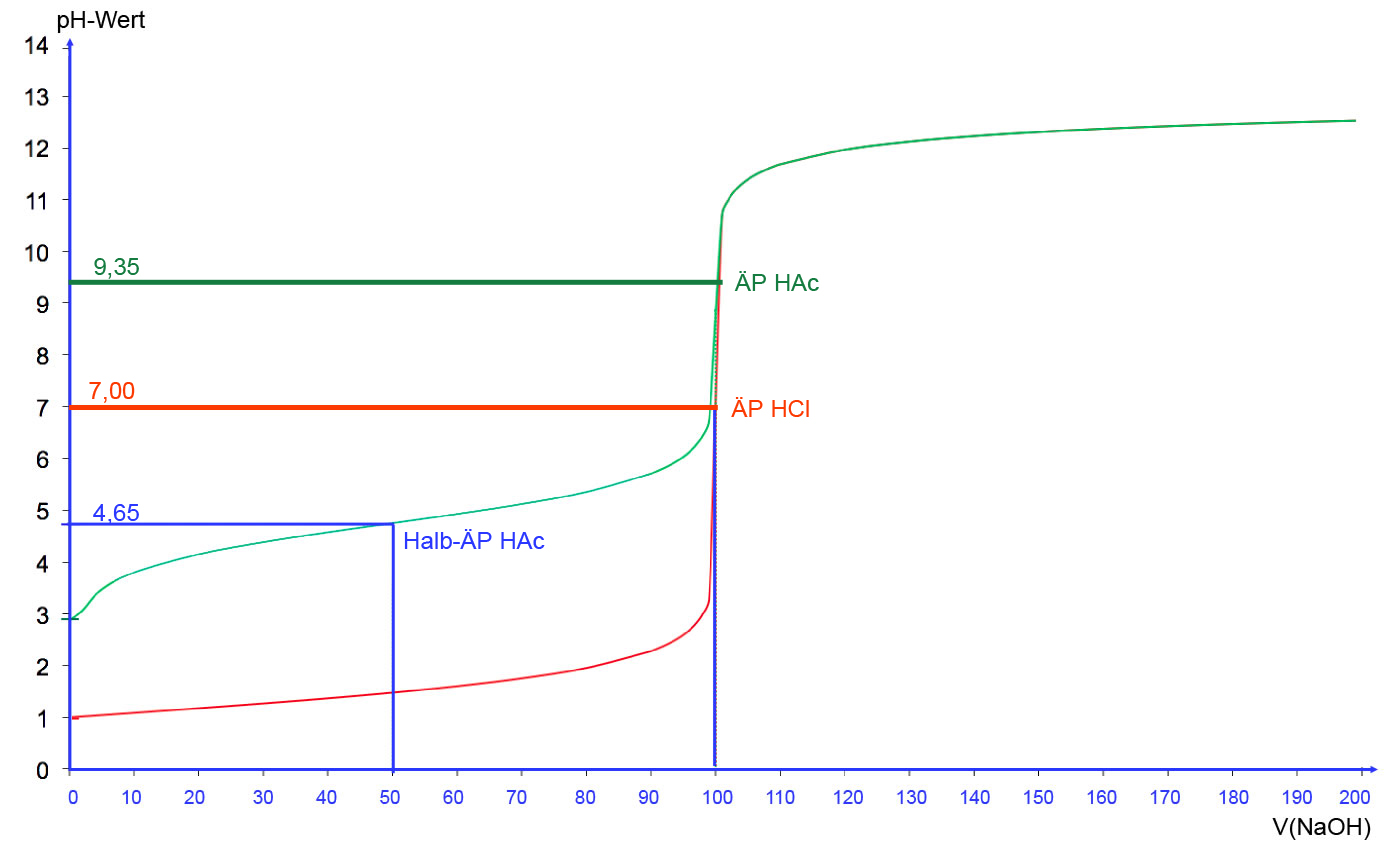
Die grüne Kurve beginnt schon bei einem relativ hohen pH-Wert von ca. 3. Das liegt daran, dass keine starke Säure titriert wird, sondern eine schwache, deren Ausgangs-pH-Wert bei 3 liegt.
Nach der Zugabe der ersten Milliliter NaOH nimmt der pH-Wert der Lösung relativ stark zu und erreicht nach 50 ml NaOH einen Wert zwischen 4,5 und 4,8.
Bei weiterer NaOH-Zugabe steigt die Kurve wieder langsamer an, um nach ca. 90 ml NaOH steil anzusteigen. Nach 100 ml NaOH ist der Äquivalenzpunkt erreicht, der bei einem pH-Wert zwischen 8 und 9 liegt.
Danach flacht die Kurve auf hohem Niveau bei pH = 11 bis 13 wieder ab. Auf pH = 14 kann die Kurve nicht gehen, weil ja nur eine 0,1 molare NaOH verwendet wurde und nicht eine 1 molare.
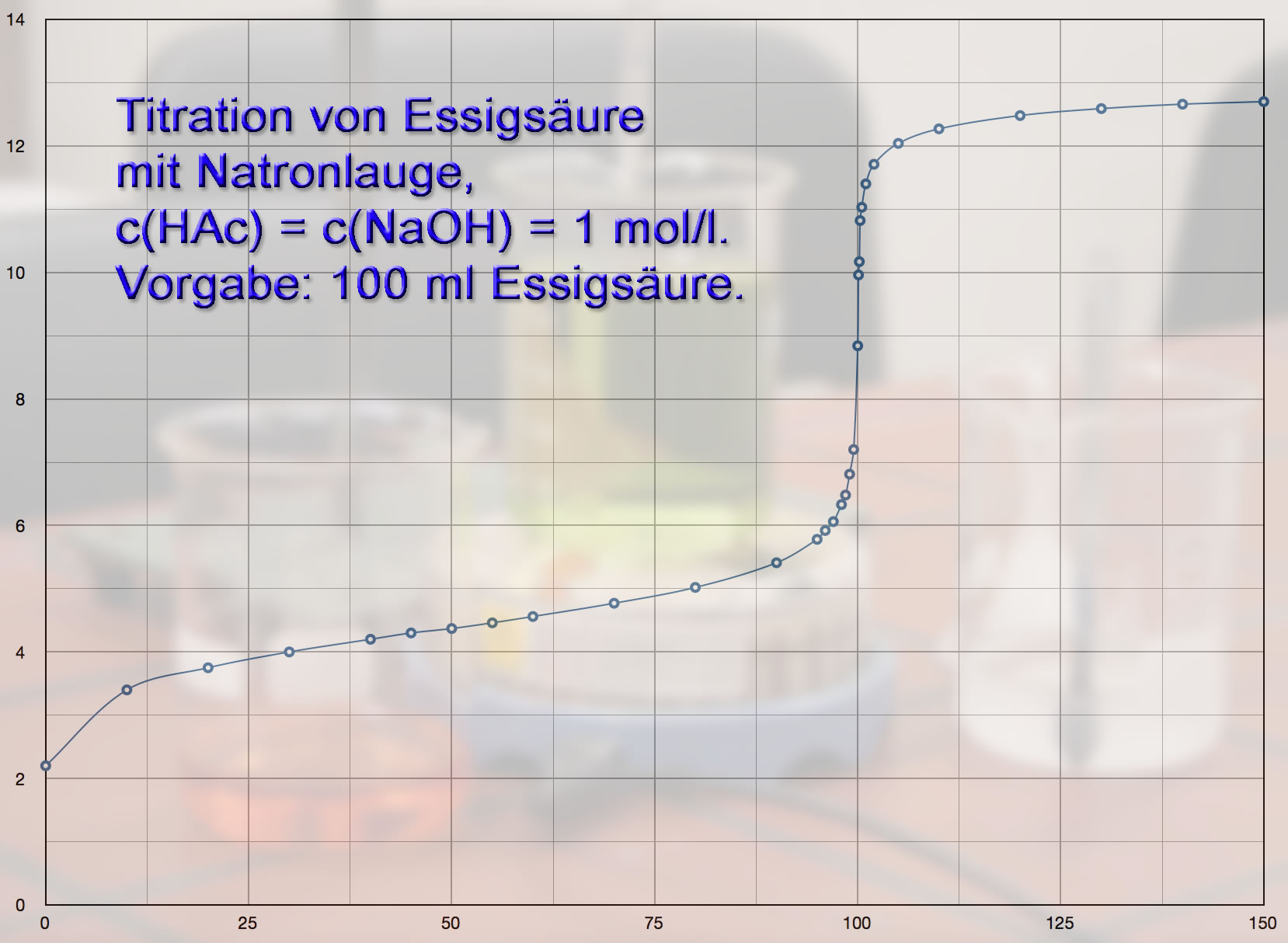
Der Versuch 12 wurde regelmäßig von meinen Chemie-Grundkursen durchgeführt, allerdings mit Essigsäure- und Natronlauge-Konzentration von 1 mol/l.
Statt aus einer Bürette wurden die 10ml-Dosen NaOH aus Pipetten zugegeben, um die Sache zu beschleunigen. Sonst hätte bei insgesamt 200 ml NaOH die 50ml-Bürette dreimal nachgefüllt werden müssen, was immer ein gewisses Sicherheitsrisiko darstellt.
Die Bürette wurde erst in der Nähe des Äquivalenzpunktes eingesetzt, um kleinere NaOH-Dosen zugeben zu können.
Hier die graphische Darstellung der Versuchsergebnisse:
Erklärungen
Drei Tatsachen fallen bei der Titrationskurve sofort auf:
- Die Kurve beginnt nicht bei einem pH-Wert von 0, sondern bei einem pH-Wert von ca. 3. Wie man leicht ausrechnen kann, liegt der pH-Wert einer 0,1-molaren Essigsäure bei 2,8.
- Am Anfang der Titration steigt die Kurve relativ stark an. Das liegt daran, dass wir zu Beginn der Titration noch reine Essigsäure vorliegen haben, die noch keine Puffer-Eigenschaften hat. Die zugegebene NaOH wird also noch nicht abgepuffert. Erst wenn genügend NaOH zugegeben wurde, bildet sich Natriumacetat, das dann zusammen mit der Essigsäure als Pufferlösung wirkt. Daher der anschließende langsame Anstieg der Kurve.
- Der Äquivalenzpunkt liegt nicht bei pH = 7, sondern bei pH = 9,3. Das liegt daran, das Natriumacetat, das Salz, das sich bei der Neutralisation von Essigsäure mit Natronlauge bildet, ein alkalisches Salz ist. Eine Lösung dieses Salzes - und nichts anderes liegt nach der Neutralisation der Essigsäure ja vor - hat einen pH-Wert um 9,3.
Halbäquivalenzpunkt
Ein wichtiger Begriff bei der Titration schwacher Säuren ist der Halbäquivalenzpunkt. Mathematisch definiert ist dieser Punkt als Wendepunkt der flachen Kurve vor dem Äquivalenzpunkt. Chemisch entspricht der Halbäquivalenzpunkt genau dem pKS-Wert der schwachen Säure, in diesem Fall also 4,65 (pKS-Wert von Essigsäure).
Bei dem oben erwähnten Versuch stimmen die mathematische und die chemische Definition leider nicht überein. Der Wendepunkt der Kurve liegt bei pH = 4,5, also etwas niedriger als der pKS-Wert der Essigsäure. Aber so ist das eben bei Schülerversuchen, die mit bescheidenen Schulmitteln durchgeführt werden.