In dem Versuch 11 haben Sie Natronlauge mit Salzsäure titriert und dabei festgestellt, dass kurz vor Erreichen des Äquivalenzpunkt bereits wenige Tropfen HCl ausreichen, um den pH-Wert sprungartig abfallen zu lassen. Dasselbe passiert, wenn man destilliertes Wasser mit wenigen Tropfen Säure oder Lauge versetzt: Der pH-Wert sinkt schlagartig ab bzw. steigt schlagartig an (siehe dazu Rechnung auf der Vertiefungsseite).
Beispiel Blut
Stellen Sie sich einmal vor, Blut wäre eine normale wässrige Lösung. Dann würde schon der Verzehr von ein paar Gurken, Sauerkraut oder Zitronensaft den pH-Wert des Blutes auf Werte von 4 oder 3 sinken lassen, und alle Proteine des Blutes würden sofort gerinnen. Innerhalb weniger Minuten nach dem Genuss Ihrer finalen Gurke wären Sie tot! Unser Blut ist aber chemisch so zusammengesetzt, dass ein paar Milliliter Säure oder Lauge den pH-Wert nicht verändern.
Unser "Kunstblut"
In dem folgenden Versuch wollen wir künstliches Blut herstellen und untersuchen, wie es sich verhält, wenn man eine Säure oder eine Lauge zufügt.
Versuch 14
Herstellung und Untersuchung von "Kunstblut"
Durchführung:
Lösen Sie in 200 ml Wasser gleiche Stoffmengen Essigsäure und Natriumacetat (zum Beispiel je 0,1 mol). Falls Sie ein pH-Meter zur Verfügung haben, geben Sie etwas Neutralrot in die Lösung, um die Sache "echter" zu machen. Wenn Sie kein pH-Meter haben, müssen Sie Universalindikator verwenden; in diesem Fall dürfen Sie die Lösung nicht anfärben.
Verteilen Sie jede Lösung auf zwei kleine Bechergläser. Füllen Sie zur Kontrolle zwei andere kleine Becherglas mit je 100 ml dest. Wasser.
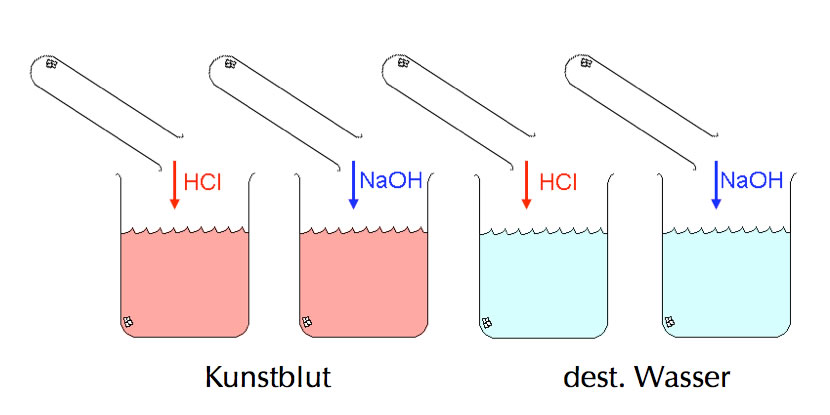
Die Versuchsanordnung mit vier Bechergläsern
Geben Sie dann portionsweise (entsprechend der Tabelle) Salzsäure bzw. Natronlauge der Konzentration 1 mol/l in die vier Bechergläser, notieren Sie die gemessenen pH-Werte (oder die Farbe des Universalindikators) und vervollständigen Sie die Tabelle:
| Lösung im Becherglas | Zugabe von | 0 ml | 1 ml | 2 ml | 5 ml | 10 ml | 20 ml |
| dest. Wasser | Salzsäure | ||||||
| dest. Wasser | Natronlauge | ||||||
| Acetatpuffer | Salzsäure | ||||||
| Acetatpuffer | Natronlauge |
Stellen Sie Ihre Ergebnisse in Form von vier Graphen in einem Koordinatensystem dar:
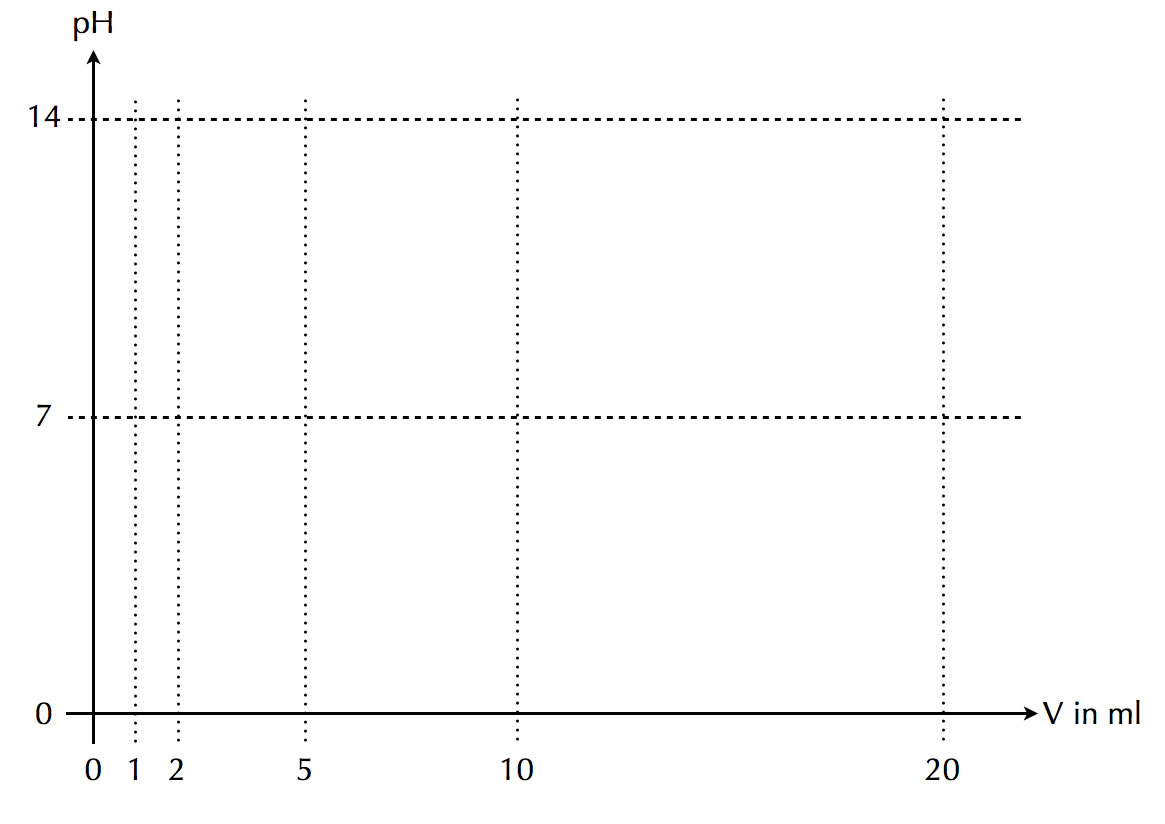
Muster für die graphische Darstellung
Beobachtungen:
Bei Zugabe von Salzsäure bzw. Natronlauge verändert sich der pH-Wert des destillierten Wassers drastisch (von 7,6 nach 0,8 bzw von 7,6 nach 13,0). Beim Acetatpuffer dagegen verändert sich der pH-Wert nur sehr wenig.
Wie üblich, erfolgt die Deutung dieses wichtigen Versuchs auf der nächsten Seite.