4.1 Rekapitulation Schulwissen
In der Schule haben Sie vielleicht Cyclopentan und Cyclohexan kennengelernt, bei diesen Cycloalkanen tritt so gut wie keine Ringspannung auf, daher wurde das Thema wahrscheinlich in der Schule noch nicht besprochen.
Haben Sie schon einmal versucht, mit einem Molekülbaukasten ein Cyclopropan-Molekül zu bauen? Ist Ihnen das unfertige Modell dabei auch schon mal regelrecht aus den Händen gesprungen, weil sich die dritte C-C-Einfachbindung, die Sie gerade erstellen wollten, wieder aufgesprungen ist? Dann haben Sie gemerkt, wie viel Energie in einem solchen engen Ring aus C-Atomen gespeichert ist. Diese Energie bezeichnet man als Ringspannung.
4.2 Studienvorbereitung
4.2.1 Zustandekommen der Ringspannung
Die Ringspannung eines Cycloalkans setzt sich aus drei Komponenten zusammen, der Winkelspannung, der Torsionsspannung und - bei größeren Ringen - einer transannularen Spannung(Einzelheiten siehe die entsprechenden Seiten im Chemie-Lexikon).
Beim Cyclopropan hat vor allem die Winkelspannung einen erheblichen Einfluss auf die Ringspannung.
Winkelspannung des Cyclopropans
Die sp3-Hybridorbitale eines C-Atoms bilden Winkel von ca. 109 Grad aus. Die Winkel in einem gleichseitigen Dreieck haben dagegen einen Wert von 60 Grad. Wenn drei Kohlenstoff-Atome ein Cyclopropan-Molekül bilden sollen, besteht genau dieses Problem.
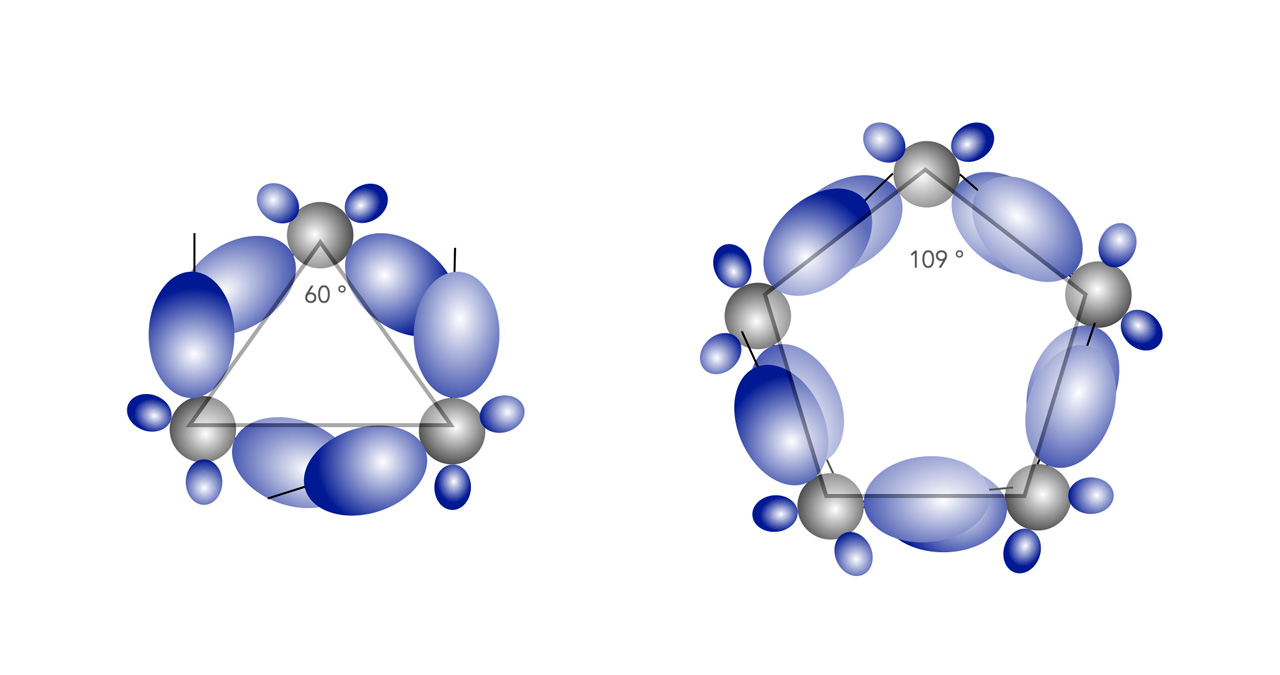
Überlappung der sp3-Orbitale bei Cyclopropan und Cyclopentan
Autor: Ulrich Helmich 01/2023, Lizenz: Public domain
Links im Bild sehen wir das Cyclopropan-Molekül in der Aufsicht. Die Kugelwolken bzw. Orbitale der drei C-Atome überlappen sich nur sehr schwach. Damit überhaupt eine "vernünftige" Bindung zustande kommt, "verbiegen" sich die Orbitale der C-Atome so, dass sie Winkel von 104º bilden [2]. Dann ist die Überlappung etwas stärker als in dem Bild gezeigt, und die Bindung zwischen den C-Atomen ist etwas stabiler. Aber die nur schwache Überlappung der Orbitale führt zu einer großen Winkelspannung.
Torsionsspannung beim Cyclopentan
Beim Cyclopentan - rechts im Bild - dagegen können die Orbitale sehr gut überlappen, weil die Winkel eines gleichseitigen Fünfecks fast genau dem Tetraederwinkel entsprechen, daher können die sp3-Hybridorbitale vollständig überlappen - die Winkelspannung ist hier also relativ klein.
Dennoch besteht auch beim Cyclopentan eine messbare Ringspannung, da alle 10 H-Atome ekliptisch positioniert sind (also deckungsgleich hintereinander stehen), diese führt zu einer Torsionsspannung, die sich dann auf die Ringspannung auswirkt.
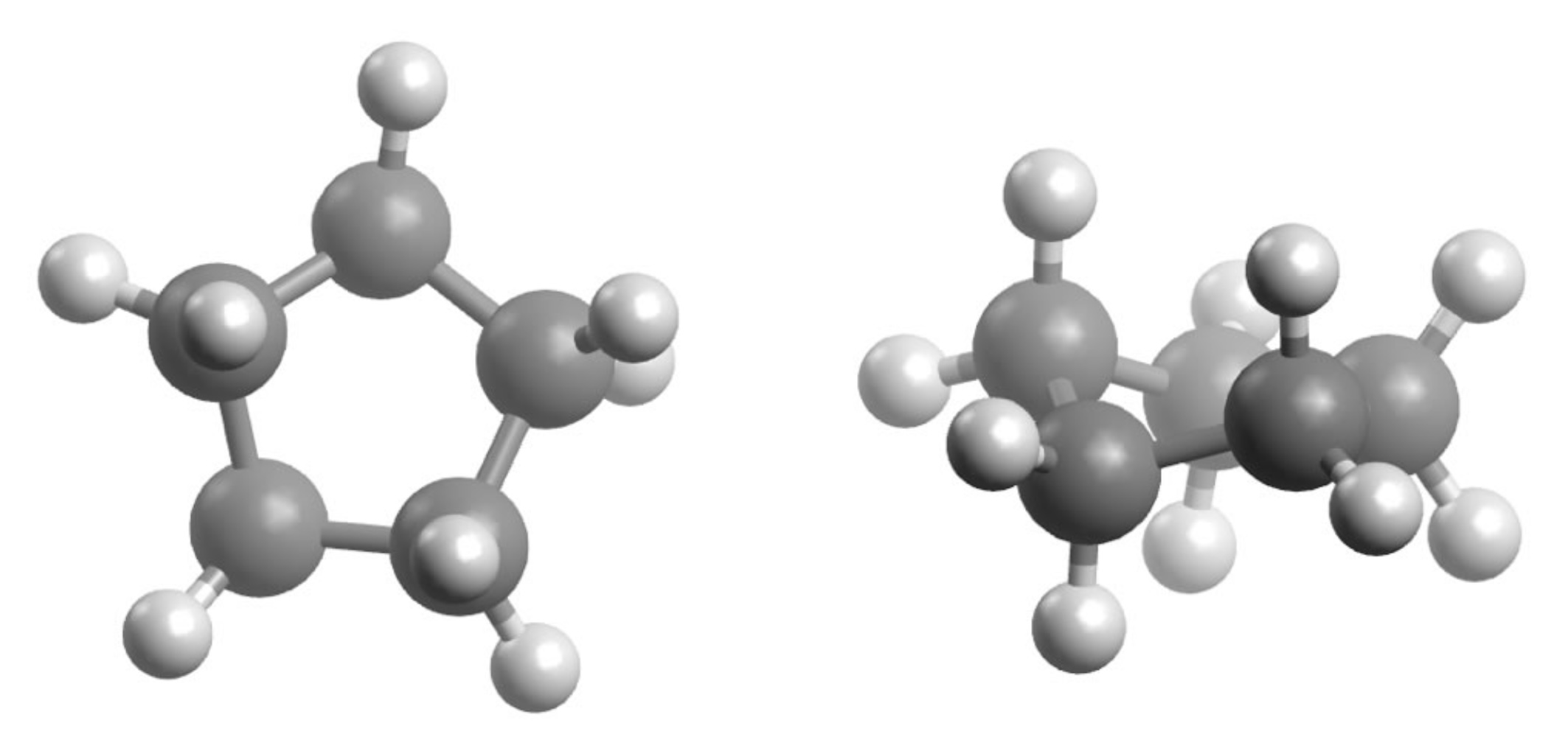
Ekliptische Stellung der H-Atome beim Cyclopentan
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Dieses Bild zeigt links das planare Cyclopentan-Molekül in der Aufsicht. Die Elektronenwolken der 10 C-H-Bindungen stoßen sich ab, was zu einer recht hohen Torsionsspannung führt. Daher kommt das Cyclopentan so gut wie nicht in der planaren Konformation vor, sondern nimmt eine leicht gewinkelte Konformation ein (rechts). Dort ist zwar die Winkelspannung wieder etwas höher als in der planaren Konformation, aber die Torsionsspannung nimmt stark ab, so dass die Ringspannung insgesamt recht niedrig ist.
4.2.2 Experimentelle Ermittlung der Ringspannung
Experimentell konnte man die Winkelspannung durch Messung der Bindungsdissoziationsenergien für die C-C-Einfachbindung nachweisen. In Alkanen wie Ethan oder Propan beträgt diese Energie 377 kJ/mol, im Cyclopropan hat man jedoch nur 272 kJ/mol gemessen[2], also deutlich weniger.
4.2.2.1 Die Verbrennungsenthalpien der Cycloalkane
Schauen wir uns einmal die experimentell ermittelten Verbrennungsenthalpien der ersten vier Cycloalkane an:
- Cyclopropan: -2091 kJ/mol
- Cyclobutan: -2744 kJ/mol
- Cyclopentan: -3320 kJ/mol
- Cyclohexan: -3952 kJ/mol
Das Cyclohexan-Molekül weist so gut wie keine Ringspannung auf, da alle sechs C-C-Einfachbindungen Winkel von 109,5 Grad bilden - also die typischen Tetraederwinkel. Die Winkelspannung ist also fast Null. Eine Torsionsspannung ist ebenfalls kaum vorhanden, und eine transannulare Spannung liegt ebenfalls nicht vor, dafür ist der Ring zu klein. Teilen wir den Wert der Verbrennungsenthalpie durch 6, erhalten wir -658,7 kJ/mol als Wert für eine C-C-Einfachbindung - das ist quasi unser Referenzwert.
Das Cyclopropan sollte daher eine Verbrennungswärme von 3 x -658,7 = -1.976,1 kJ/mol besitzen, experimentell findet man aber -2091 kJ/mol, also werden rund 115 kJ/mol mehr freigesetzt als theoretisch erwartet. Diese zusätzliche freigesetzte Energie ist auf die enorme Winkelspannung des Cyclopropan-Moleküls zurückzuführen!
Für das Cyclobutan würden wir 4 x -658,7 = -2.634,8 kJ/mol erwarten, die Abweichung zur gemessenen Verbrennungswärme beträgt hier rund 109 kJ/mol, das ist schon etwas weniger als beim Cyclopropan.
Für Cyclopentan ergibt die Rechnung 4 x -658,7 = -3.293,5 kJ/mol, das ist eine zusätzliche Energie von nur noch ca. 27 kJ/mol. Die Ringspannung ist hier nur noch sehr gering. Die Gründe dafür haben wir bereits weiter oben ausgeführt.
4.2.3 Die Ringspannung wird von drei Kräften bestimmt
4.2.3.1 Winkelspannung
Der erste Faktor, der die Ringspannung beeinflusst, ist die sogenannte Winkelspannung. Das ist "die Energie, die benötigt wird, um die tetraedrischen Kohlenstoffatome so weit zu verzerren, dass der Ringschluss möglich ist" [2]. Nach ihrem Entdecker wird diese Kompomente der Ringspannung auch als Baeyer-Spannungbezeichnet.
Besonders stark wirkt dieser Faktor beim Cyclopropan, wie wir bereits im vorherigen Abschnitt gesehen haben. Nochmal zur Wiederholung: Ein gleichseitiges Dreieck hat Winkel von 60 Grad, ein tetraedrisches C-Atom dagegen bildet Bindungswinkel von 109,5 Grad aus. Im Cyclopropan findet man experimentell einen Orbitalwinkel von 104 Grad, mehr kann sich das C-Atom aber nicht "verbiegen". Die sp3-Hybridorbitale überlappen also nur sehr schwach, geringste Einflüsse von außen "sprengen" die schwachen C-C-Bindungen (siehe Abbildung 2).
4.2.3.2 Torsionsspannung
Der zweite Faktor, der sich auf die Ringspannung auswirkt, ist die konformative Spannung, oft auch als Torsionspannung bezeichnet oder nach ihrem "Entdecker" auch Pitzer-Spannung genannt.
Schauen wir uns dazu das Modell einesCyclopropan-Moleküls an:
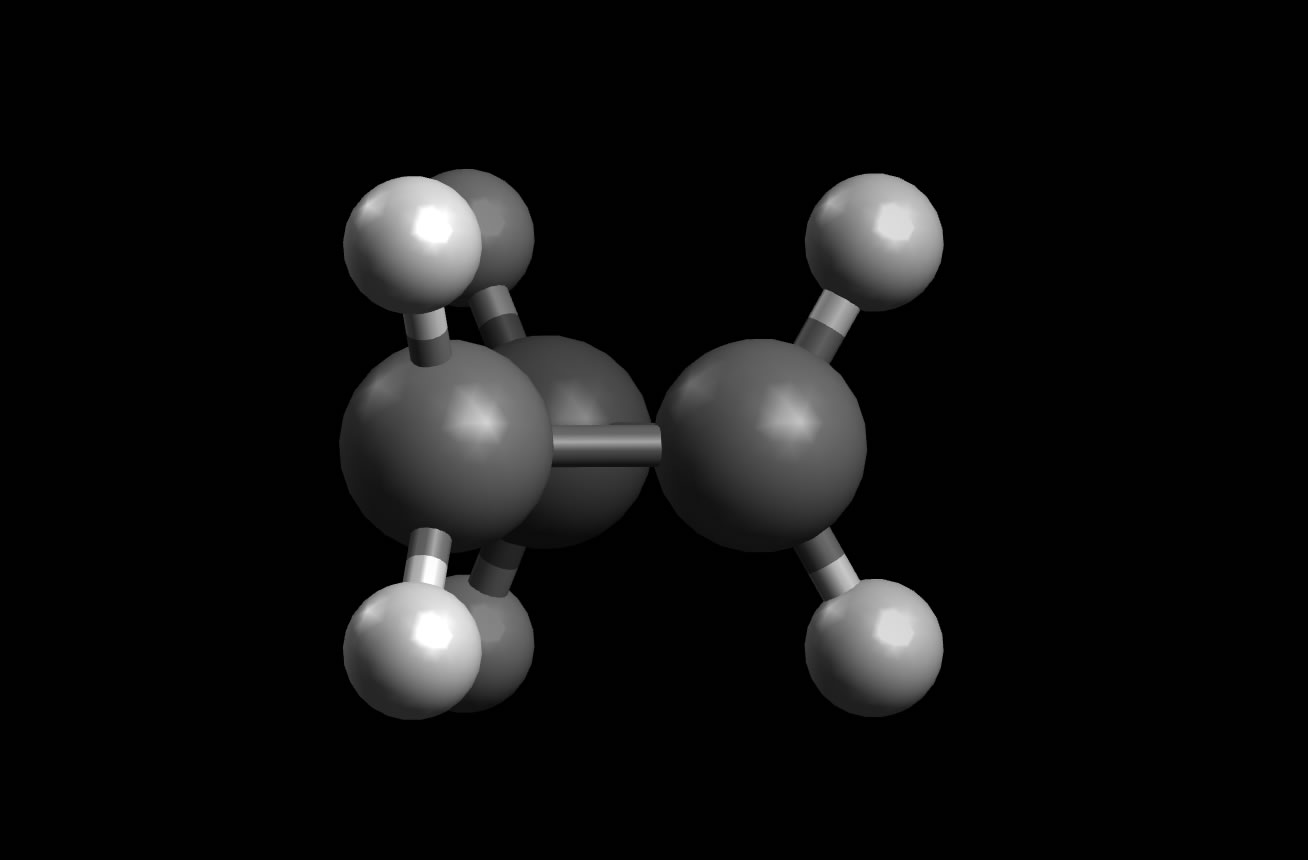
Das Cyclopropan-Molekül
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Man sieht sofort, dass die H-Atome in einer ekliptischen bzw.verdeckten Konformation vorliegen, die Bindungselektronen der C-H-Bindungen kommen sich also sehr nahe, was zu einer gewissen Abstoßung führt, einer sogenannten van-der-Waals-Abstoßung.
Für Cyclopropan hat die Winkelspannung einen Anteil von 78 kJ/mol und die Torsionsspannung einen Anteil von 38 kJ/mol an der Ringspannung von 116 kJ/mol.
Bei größeren Ringen gibt es noch einen dritten Faktor, der die Ringspannung beeinflusst.
4.2.3.3 Transannulare Wechselwirkung
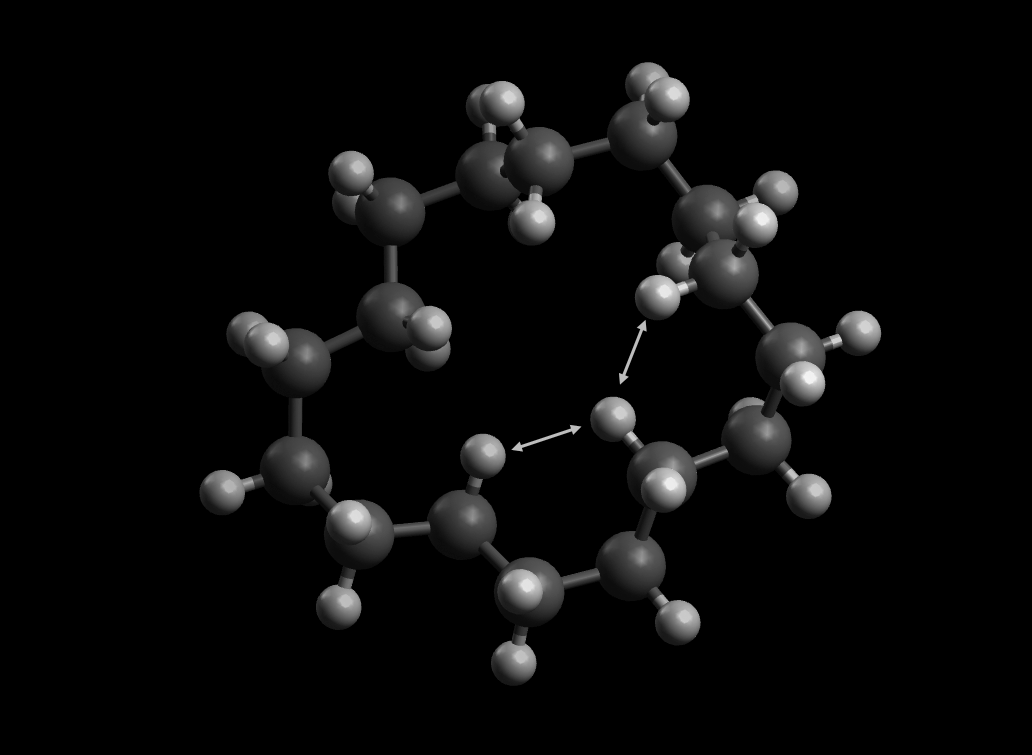
Ein Cycloalkan mit 12 C-Atomen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir ein großes Cycloalkan, ein Cyclododecan mit 12 C-Atomen. Die weißen Pfeile deuten an, dass sich hier die Elektronenwolken nicht-benachbarter, relativ weit entfernter H-Atome miteinander wechselwirken - sich also abstoßen. Solche Wechselwirkungen, die nur bei großen Ringen vorkommen, bezeichnet man als transannulare Wechselwirkung oder - nach ihrem Entdecker - Prelog-Spannung.
Bei großen Ringen spielen die beiden anderen Komponenten der Ringspannung so gut wie keine Rolle mehr, große Ringe ähneln im Prinzip langen Ketten, deren Enden sich zusammengeschlossen haben. Eine verdeckte Konformation kann hier durch relativ freies Drehen um die C-C-Achsen leicht vermieden werden, so dass die Pitzer-Spannung (Torsionsspannung) recht klein ist. Ebenso tritt kaum eine Baeyer-Spannung (Winkelspannung) auf, die Bindungswinkel betragen 109,5 Grad oder sind zumindest nicht weit davon entfernt.
Zwei Cycloalkane werden auf meiner Homepage besonders ausführlich besprochen, nämlich Cyclopentan und Cyclohexan. Wenn Sie sich dafür interessieren, besuchen Sie doch bitte die entsprechenden Lexikonseiten.
Merke:
Die drei Komponenten der Ringspannung
Die Ringspannung von Cycloalkanen setzt sich aus drei Anteilen zusammen:
Baeyer-Spannung (Winkelspannung): entsteht durch Abweichung der C-C-C-Bindungswinkel vom idealen Tetraederwinkel (109,5º).
Pitzer-Spannung (Torsionsspannung, konformative Spannung): beruht auf ekliptischer Anordnung von Bindungen, wenn keine vollständig gestaffelte Konformation möglich ist.
Prelog-Spannung (transannulare Spannung): tritt bei größeren Ringen auf und entsteht durch sterische Wechselwirkungen (Abstoßungskräfte) zwischen nicht-benachbarten Atomen und Atomgruppen.
Die Ringspannung eines Cycloalkans ist die Summe aus diesen drei Komponenten.
Auf dieser Seite im Lexikon Chemie erfahren Sie noch ein paar weitere Einzelheiten zum Thema Ringspannung der Cycloalkane
Was sagt die Fachliteratur?
Schauen wir jetzt mal wieder in die unten aufgeführten Hochschul-Lehrbücher. Was sagen die zum Thema "Ringspannung der Cycloalkane"?
Im Fox/Whitesell finden sich ein paar Sätze zur Ringspannung. Interessant ist, dass hier Folgendes hervorgehoben wird: "Aufgrund dieser Spannung hat Cyclopropan eine höhere potentielle Energie als ein nicht gespanntes Molekül. Diese als Spannungsenergie bezeichnet Extraenergie wird bei der Verbrennung von Cyclopropan freigesetzt und beträgt ungefähr 117 kJ/mol" [1, S. 20].
In diesem Buch findet sich auch eine schöne Tabelle mit den Spannungsenergien:
| Verbindung | Spannungsenergie in kJ/mol |
| Cyclopropan | 115,5 |
| Cyclobutan | 110,5 |
| Cyclopentan | 27,2 |
| Cyclohexan | 0 |
| Cycloheptan | 26,35 |
| Cyclooctan | 40,2 |
| Cyclononan | 52,7 |
im Vollhardt/Schore gibt es ein eigenes großes Kapitel zur Ringspannung der Cycloalkane, viele Fakten, die auf dieser Webseite genannt werden, stammen aus diesem Buch.
Der Clayden widmet sich der Ringspannung auf mehreren Seiten, und im Morrison/Boyd findet sich ebenfalls ein größerer Abschnitt zur "Baeyer strain theory".
Das Thema wird also in allen Lehrbüchern der Organischen Chemie ausführlich behandelt.
Quellen:
- Fox, M. A.; Whitesell, J. K.: Organische Chemie – Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage. Heidelberg: Springer, 1995.
- Vollhardt, K. P. C.; Schore, N. E.: Organische Chemie. 6. Auflage. Weinheim: Wiley-VCH, 2020.
- Clayden, J.; Greeves, N.; Warren, S.: Organische Chemie. Berlin: Springer, 2013.
- Morrison, R. T.; Boyd, R. N.; Bhattacharjee, S. K.: Organic Chemistry. 7. Auflage. Harlow: Pearson, 2011.
Seitenanfang -
Weiter mit den Reaktionen der Cycloalkane sowie Synthesemöglichkeiten ...