Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
-
funktionelle Gruppen verschiedener Stoffklassen und ihre Nachweise:
Hydroxy-Gruppe,Carbonyl-Gruppe, Carboxy-Gruppeund Ester-Gruppe
*nach dem Kernlehrplan des Landes NRW 2022
Essigsäure und Essig
Die Essigsäure (Ethansäure) ist zwar nicht die einfachste Carbonsäure, wohl aber die bekannteste. Essigsäure ist der geschmacksbestimmende Bestandteil des Essigs, eines beliebten "Gewürzes", das sich aus der Küche nicht wegdenken lässt. Der übliche Haushaltsessig ist nichts anderes als eine ca. 5%ige Essigsäure, die mit verschiedenen Aromastoffen versetzt ist.
Wer mehr über Essig wissen möchte, geht am besten auf diese ausführliche Seite in der Wikipedia.
Schauen wir uns doch einfach erst mal die Strukturformel dieser wichtigen Carbonsäure an.
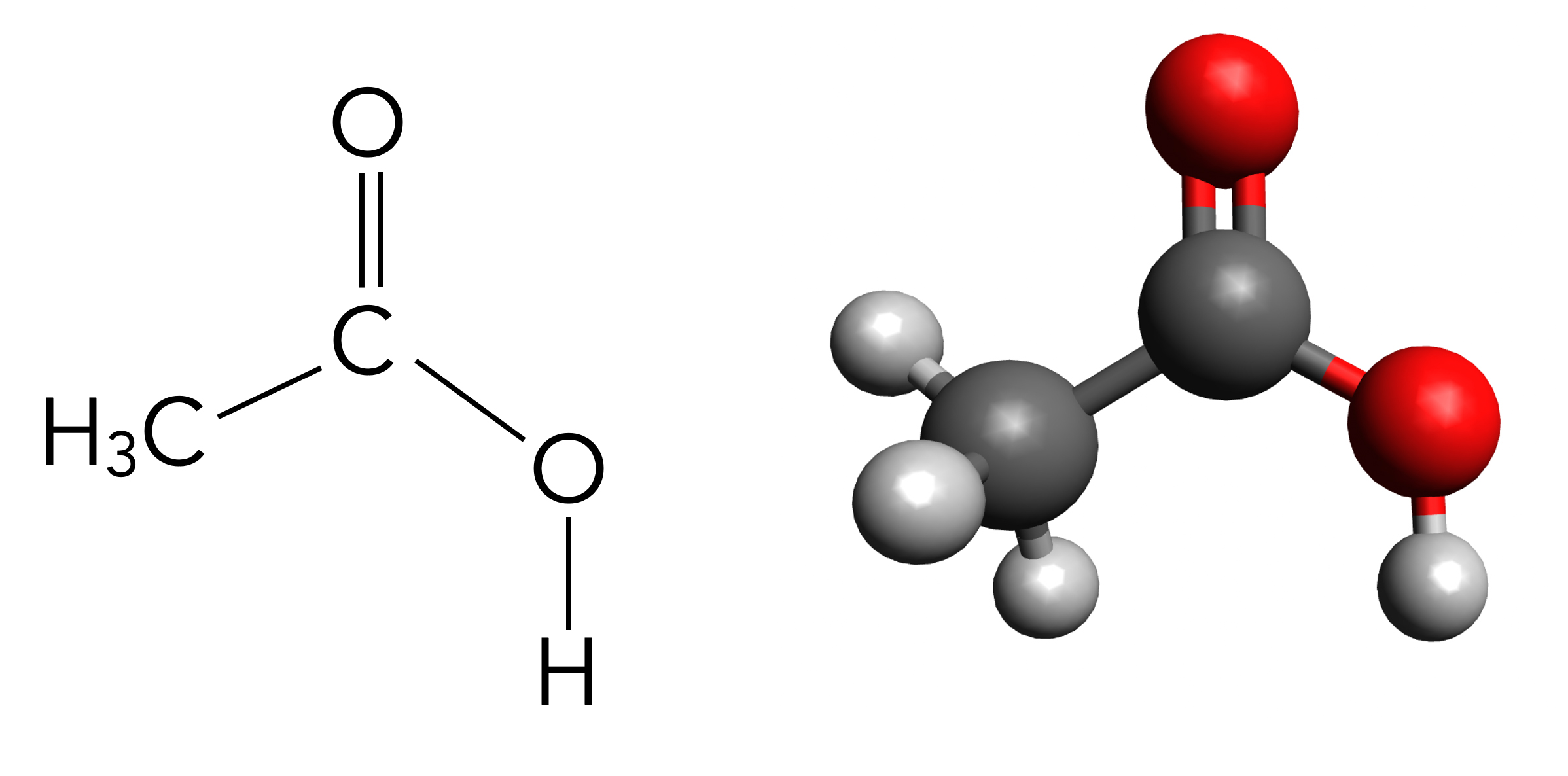 Strukturformeln von Acetaldehyd und Essigsäure im Vergleich
Strukturformeln von Acetaldehyd und Essigsäure im Vergleich
Autor: Ulrich Helmich 2025, Lizenz: Public domain.
Wir sehen, dass die Strukturformel von Essigsäure Ähnlichkeit mit der Strukturformel von Acetaldehyd hat, dem Oxidationsprodukt des Ethanols. Und tatsächlich - Essigsäure ist nichts anderes als das Oxidationsprodukt von Acetaldehyd.
Damit ist Essigsäure eigentlich auch nichts anderes als das Oxidationsprodukt von Ethanol. Und genau das passiert auch, wenn man beispielsweise eine Flasche Wein nicht richtig lagert. Der Alkohol Ethanol im Wein oxidiert, zunächst zum Aldehyd Ethanal und dann im zweiten Schritt zur Carbonsäure Ethansäure.
Zur Herstellung von Essig
(Auszug aus dem Wikipedia-Artikel, Abschnitt "Geschichte")
Als Grundlage hierfür können alkoholhaltige Flüssigkeiten, beispielsweise Wein, Apfelmost, Bier, Reiswein, Malzsud oder zuckerhaltige Flüssigkeiten wie Traubensaft beispielsweise für den Aceto balsamico di Modena dienen. Überwiegend jedoch wird Essig aus verdünntem reinen destillierten Alkohol (Agraralkohol) oder aus Verarbeitungswein in Form des sogenannten "White vinegar" hergestellt. Aus destilliertem Alkohol gewonnener Essig wird Branntweinessig genannt...
...Der Vorgang wird oft als Essigsäure-"Gärung" oder "Essig-Gärung" bezeichnet, korrekt bezeichnet ist er jedoch eine Fermentation. Er ist eine teilweise "Veratmung", da dabei Sauerstoff aus der Luft nötig ist, im Gegensatz zur alkoholischen Gärung. Daher kann Essig nicht in geschlossenen, ungelüfteten Behältern produziert werden. Für die Herstellung gibt es mehrere Verfahren.
Die Carboxy-Gruppe
Betrachten wir nun die Carboxy-Gruppe einmal näher:
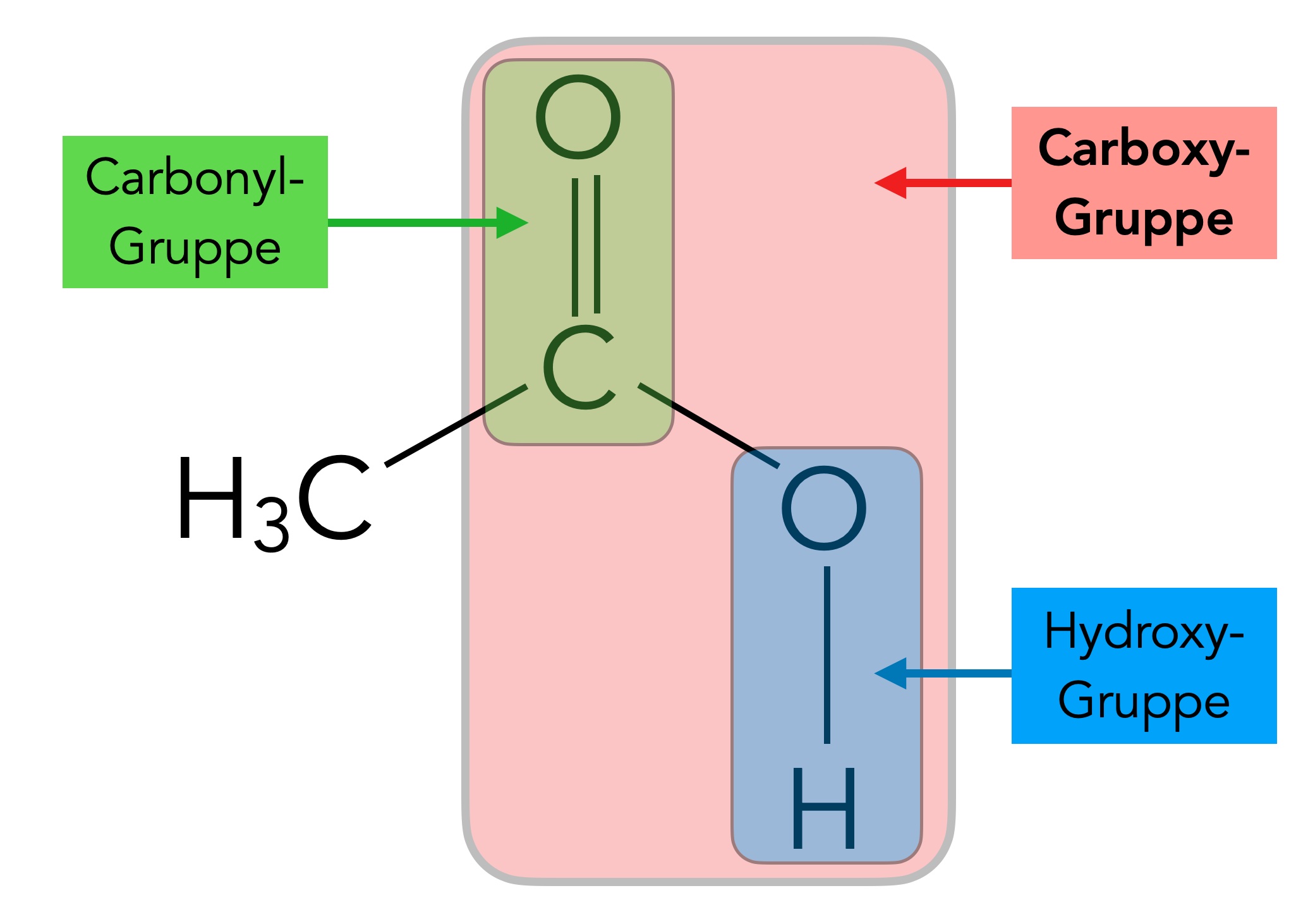
Die Carboxy-Gruppe
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Dieses Bild zeigt den Aufbau der Carboxy-Gruppe, meistens auch als COOH-Gruppe bezeichnet. Die COOH-Gruppe besteht aus einer Carbonyl-Gruppe, die mit einer Hydroxy-Gruppe verbunden ist.
Die Carbonyl-Gruppe kennen wir bereits von den Aldehyden und Ketonen her, sie verleiht diesen Verbindungen einen ausgesprochenen Dipol-Charakter und ist für die relativ hohen Siedetemperaturen sowie für die Wasserlöslichkeit verantwortlich, und natürlich auch für das chemische Verhalten, auf das wir aber erst in der Qualifikationsphase eingehen werden.
Die Hydroxy-Gruppe kennen wir von den Alkoholen her. Sie ist für die sehr hohen Siedetemperatur und die sehr gute Wasserlöslichkeit verantwortlich. Die OH-Gruppe ist ein H-Brücken-Donator und kann sowohl mit den OH-Gruppen wie auch mit den Carbonyl-O-Atomen anderer Moleküle H-Brücken bilden.
Essigsäure ist eine Säure
Versetzt man Essigsäure mit Universalindikator, so färbt sich dieser intensiv rot. Gibt man in ein Reagenzglas mit verdünnter Essigsäure etwas Magnesiumband oder Zinkpulver, so setzt eine mehr oder weniger heftige Reaktion ein, bei der sich das Metall schnell (Magnesium) bzw. langsam (Zink) auflöst. Außerdem entsteht bei der Reaktion das Gas Wasserstoff, das leicht mit der Knallgasprobe nachgewiesen werden kann.
$2 \ CH_3COOH + Mg \to (CH_3COO)_2Mg + H_2$
Essigsäure heißt also nicht nur Essig-Säure, sondern ist auch tatsächlich eine Säure - nicht ganz so stark wie Salzsäure oder Schwefelsäure, aber immer noch stark genug, um unedle Metalle aufzulösen oder auf der menschlichen Haut schlimme Verätzungen hervorzurufen.
Wiederholung: Säuren
In der Sekundarstufe I haben Sie sich mit Säuren und Basen beschäftigt, genauer genommen, mit Brönsted-Säuren und -Basen.
Nach Brönsted sind Säuren Protonen-Donatoren und Basen Protonen-Akzeptoren. Das heißt, Säuren sind Teilchen (!), die in der Lage sind, ein Wasserstoff-Atom als Proton H+ abzuspalten. Basen dagegen sind Teilchen, die Protonen aufnehmen können.
Als Musterbeispiel für eine solche Protolyse (Abspaltung eines Protons von einer Säure und Übertragung auf eine Base) wird oft die Reaktion von Chlorwasserstoff mit Wasser aufgeführt:
$HCl + H_2O \to Cl^{-} + H_3O^{+}$
Ein anderes Beispiel ist die Übertragung eines Protons von Chlorwasserstoff auf Ammoniak:
$HCl + NH_3 \to Cl^{-} + NH_4^{+} \to NH_4Cl(s)$
Stellt man eine geöffnete Flasche mit konz. Salzsäure direkt neben eine geöffnete Flasche mit Ammoniaklösung, so kann man die Bildung weißer Nebel beobachten, die aus dem Salz Ammoniumchlorid NH4Cl bestehen. Auch diese Reaktion ist eine Protolyse, und zwar eine, bei der Wasser keine Rolle spielt.
Auch Ethansäure (Essigsäure) kann ein Proton an Wasser-Moleküle abgeben:
$CH_3COOH + H_2O \to CH_3COO^{-} + H_3O^{+}$
An sich gibt eine OH-Gruppe so leicht kein Proton ab. Alkohole sind in der Regel keine Säuren, auch keine schwachen Säuren. Aber das zusätzliche O-Atom in der Carboxy-Gruppe erhöht die Polarität der O-H-Bindung in der Hydroxy-Gruppe, so dass das H-Atom leichter abgegeben werden kann.
Bei der Abgabe eines Protons entsteht aus einem Essigsäure-Molekül ein Acetat-Anion, das auch als Ethanoat-Anion bezeichnet wird.
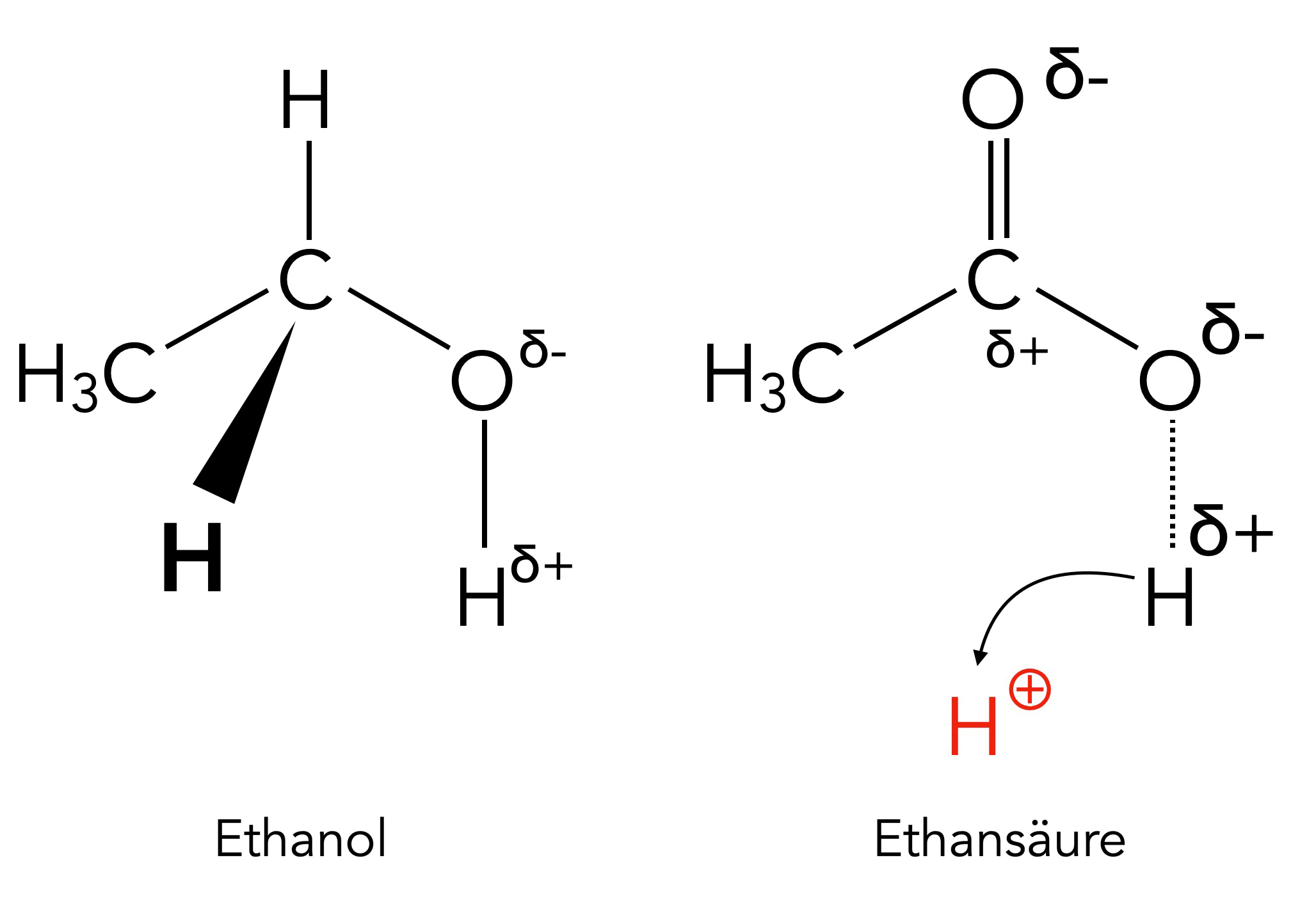
Ethanol und Ethansäure im Vergleich
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Dieses Bild zeigt die Ladungsverhältnisse im Ethanol- und im Ethansäure-Molekül. Die O-H-Bindung im Ethanol-Molekül ist recht polar, aber nicht polar genug, um zu einer spontanen heterolytischen Bindungsspaltung zu führen.
Im Ethansäure-Molekül wird die O-H-Bindung durch das zusätzliche Sauerstoff-Atom stärker polarisiert, so dass leicht ein H-Atom als Proton abgegeben werden kann.
Essigsäure gehört zu den sogeannten mittelstarken Säuren. Sie ist also schwächer als die starken Säuren (zum Beispiel Salzsäure, Schwefelsäure, Salpetersäure etc.), aber stärker als die schwachen Säuren (Kohlensäure, Blausäure, Schwefelwasserstoff etc.).
Bestimmung der Säurestärke
Experimentell kann man die Säurestärke ganz einfach grob bestimmen: Man nimmt eine 0,1-molare wässrige Lösung der Säure und misst deren pH-Wert. Je niedriger der pH-Wert dieser sauren Lösung, desto größer die Säurestärke.
| Säure, c = 0,1 mol/l | pH-Wert |
| Salzsäure | 1,08 |
| Essigsäure | 2,88 |
| Kohlensäure | 3,68 |
Auch mit Hilfe von Magnesiumband oder Zinkpulver kann man die Stärke einer Säure leicht abschätzen - aber nicht exakt bestimmen. Je schneller sich das Magnesium oder Zink in der Säure auflöst, desto stärker ist die Säure. Natürlich müssen die Säuren, die man vergleicht, ebenfalls die gleiche Konzentration haben.
In der Stufe Q1 wird das Thema "Säurestärke" intensiver behandelt. Wer Genaueres dazu wissen möchte, kann ja schon mal auf diese Seiten gehen.
Merke:
Essigsäure
Die funktionelle Gruppe der Essigsäure ist die COOH-Gruppe (Carboxy-Gruppe). Diese Gruppe verleiht der Essigsäure einen sauren Charakter, Essigsäure ist ein Protonen-Donator. Bei der Reaktion mit Wasser entstehen ein Oxonium-Ion H3O+ und ein Acetat- bzw. Ethanoat-Ion CH3COO-.
Essigsäure gehört zu den mittelstarken Säuren, ist also stärker als viele Fruchtsäuren (Äpfelsäure, Weinsäure etc.), aber deutlich schwächer als Salzsäure oder Schwefelsäure.
Aufgabe 1
Industrieessig kann nicht nur durch die Oxidation von Ethanol hergestellt werden, sondern auch durch die Reaktion von Methanol mit Kohlenmonoxid CO.
Erstellen Sie die Reaktionsgleichung für diese Umsetzung!
Aufgabe 2
Stellen Sie die Reaktionsgleichungen für folgende Reaktionen auf:
- Essigsäure mit Zink
- Essigsäure mit Kalium
- Essigsäure mit Calciumcarbonat CaCO3
Aufgabe 3
Wenn man sich eine Konservendose zum Beispiel für Erbsen näher anschaut, dann sieht man, dass die Dose innen mit einer dünnen Lage aus Kunststoff beschichtet ist.
Was würde passieren, wenn bei einer solchen Konserve mit sauren Gurken, die in Essigsäure eingelagert sind, diese Kunststoffschicht beschädigt wäre und zum Beispiel Löcher oder Risse enthielte?