Heterozyklische Verbindungen oder kurz Heterocyclen sind ringförmige organische Verbindungen mit mindestens einem Hetero-Atom (Fremd-Atom). Die wichtigsten Hetero-Atome sind Stickstoff, Sauerstoff und Schwefel. Es gibt aliphatische Heterocyclen und aromatische Heterocyclen.
Die folgende Abbildung zeigt ein paar typische aromatische Heterocyclen:
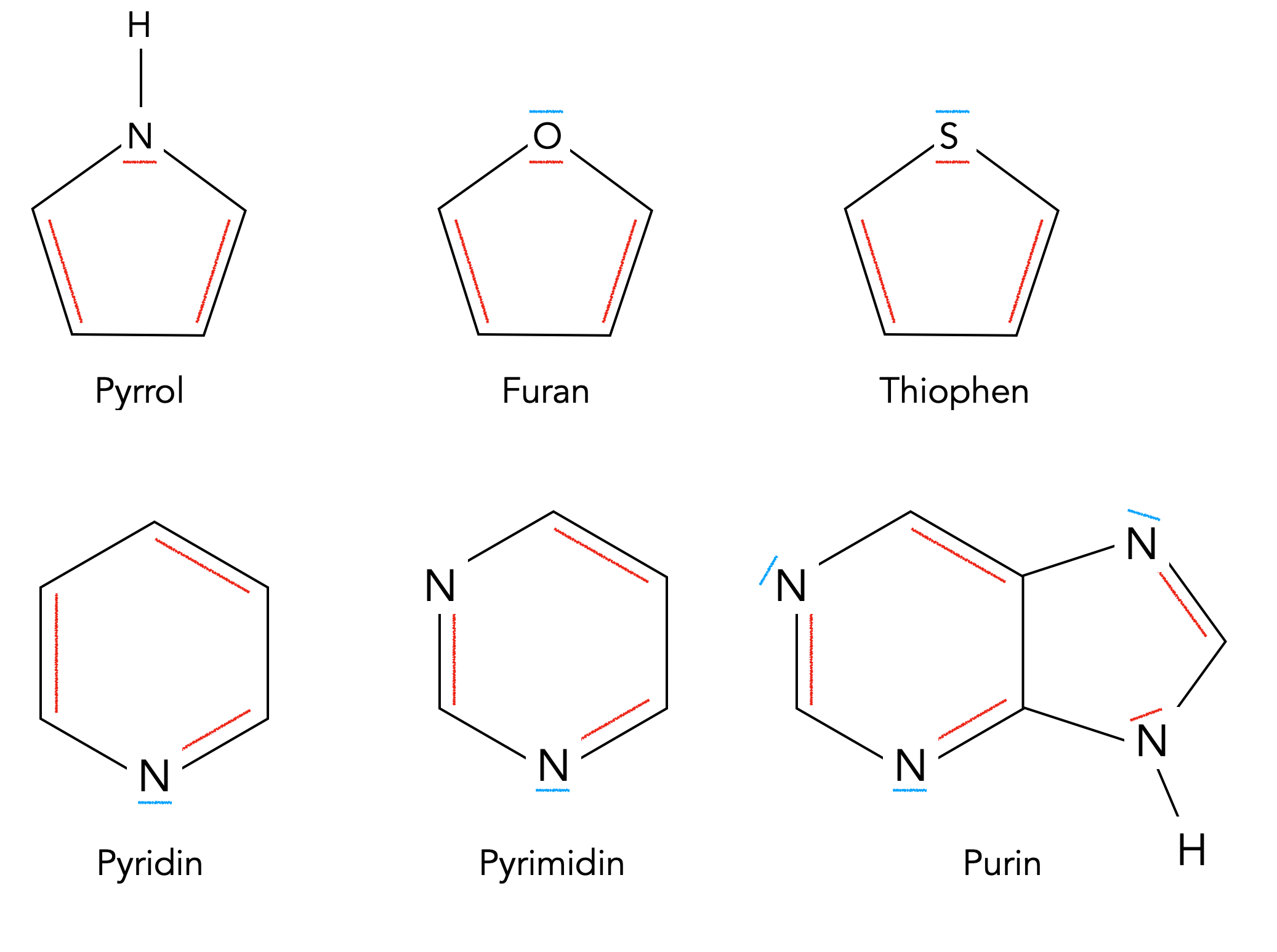
Text
Autor: Ulrich Helmich, Lizenz: Public domain
Pyrrol, Furan und Thiophen gehören zu den fünfgliedrigen Heterocyclen. Diese aromatischen Heterocyclen besitzen 6 pi-Elektronen im Ring und erfüllen somit die (4n+2)-Regel (siehe Hückel-Regel). Die N-, O- und S-Atome dieser Heterocyclen sind sp2-hybridisiert, und sie steuern ein freies Elektronenpaar in einem pz-Orbital bei. Die Hetero-Atome von Furan und Thiophen besitzen ein zweites freies Elektronenpaar, das dann aber nicht zum pi-System gehört, sondern quasi nach außen gerichtet ist und den Verbindungen damit die Eigenschaft einer Lewis-Base verleiht.
Durch ihre elektronenziehende Wirkung (-I-Effekt) verringern diese Hetero-Atome die Elektronendichte im Ring und machen diese Aromaten damit weniger angreifbar für Elektrophile.
Pyridin und Pyrimidin gehören zu den sechsgliedrigen Heterocyclen. Die (4n+2)-Regel wird durch die pi-Elektronen der Doppelbindungen erfüllt, die Hetero-Atome können ihr freies Elektronenpaar nach außen richten, für den aromatischen Charakter sind diese Elektronen nicht notwendig bzw. sogar überflüssig. Auch hier wird die Elektronendichte im Ring durch die Hetero-Atome verringert, während die Verbindungen durch die nach außen gerichteten Elektronenpaare zu Lewis-Base werden.
Purin hat insgesamt 10 pi-Elektronen (4 Doppelbindungen + 1 freies Elektronenpaar eines N-Atoms) und erfüllt damit die (4n+2)-Regel für n=2.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.