Eigenschaften
Pyrrol ist in reinem Zustand eine farblose Flüssigkeit mit einer Dichte von 0,9691 g/cm3, die stark nach Chloroform riecht. An der Luft verfärbt sich Pyrrol mit der Zeit braun und neigt zur Harzbildung.
Die Wasserlöslichkeit ist mäßig und beträgt 60 g/l bei 20 ºC, Pyrrol mischt sich aber mit den meisten organischen Lösemitteln.
Der Schmelzpunkt von Pyrrol liegt bei -24 ºC, der Siedepunkt bei 131 ºC.
Struktur
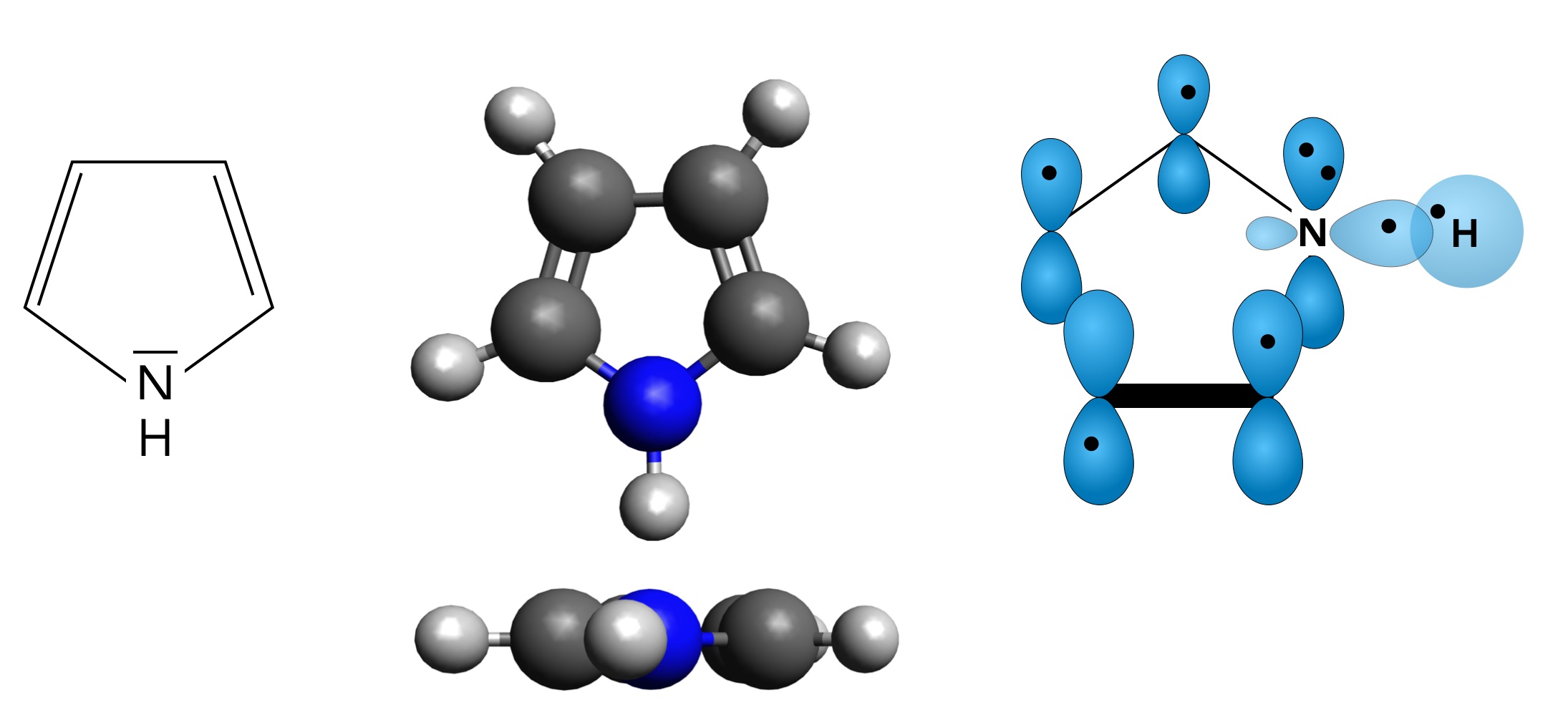
Pyrrol als Strukturformel und Molekülmodell
Autor: Ulrich Helmich 01/2024, Lizenz: CC BY-NC-SA 4.0
Links im Bild sehen wir die Strukturformel des Pyrrols. In der Mitte finden wir ein computergeneriertes Molekülmodell, einmal in der Aufsicht, einmal in der Seitenansicht. Die Seitenansicht zeigt, dass das Molekül völlig planar ist. Ganz rechts sehen wir die pz-Orbitale und das sp3-Orbital der N-H-Bindung im Pyrrol-Molekül.
Man kann leicht erkennen, dass Pyrrol zu den fünfgliedrigen aromatischen Heterocyclen gehört.
Allgemeine Informationen zu den nicht-aromatischen und aromatischen Heterocyclen finden Sie auf dieser Lexikon-Seite.
Aromatizität
Wie man auf der Abbildung sieht, ist das Pyrrol-Molekül ringförmig und planar, alle fünf Atome sind sp2-hybridisiert, die pz-Orbitale können sich gut überlappen und bilden ein Molekülorbital mit sechs pi-Elektronen: 4 kommen von den vier C-Atomen, 2 werden von dem Heteroatom Stickstoff gespendet. Damit sind alle Kriterien der Hückel-Regel erfüllt, und man kann Pyrrol zu Recht als Aromaten bezeichnen.
Diese wichtige Regel wurde von Erich Hückel (1896-1980) um 1930 aufgestellt. Mit dieser Regel kann man beurteilen, ob eine cyclische Verbindung mit Doppelbindungen aromatisch ist oder nicht.
Vergleich mit Benzol
Abgesehen davon, dass Pyrrol ein fünfgliedriger Heteroaromat und Benzol ein sechsgliedriger "normaler" Aromat ist, gibt es noch ein paar weitere Unterschiede zwischen den beiden Verbindungen.
Ladungstrennung
Trotz seiner Elektronegativität gibt der Pyrrol-Stickstoff seinen Elektronenüberschuss an die vier C-Atome ab, im Endeffekt trägt das N-Atom sogar eine positive Teilladung, die C-Atome dagegen negative Teilladungen. Das kann man auch gut an den Grenzstrukturen des Pyrrols erkennen:
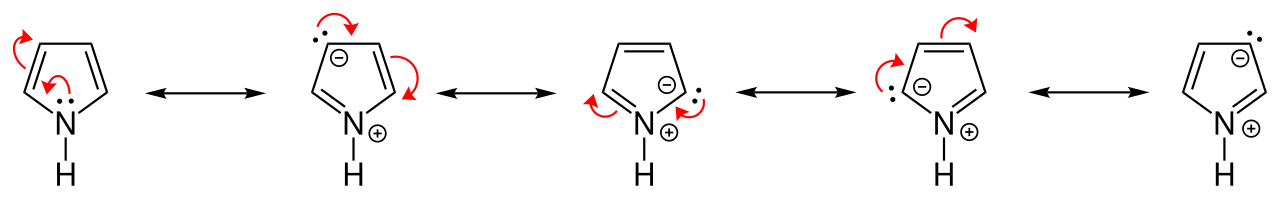
Grenzstrukturen des Pyrrols
Chem Sim 2001, Public domain, via Wikimedia Commons
Die Folge dieser Ladungstrennung ist ein Dipolmoment von 1,8 Debye mit Stickstoff als positivem Pol. Im chemischen Verhalten äußert sich diese Polarität als erhöhte Reaktionsfähigkeit gegenüber elektrophilen Angriffen.
Bindungslängen
Im Benzol-Molekül haben alle C-C-Bindungen die gleiche Länge, C-C-Einfachbindungen und C=C-Doppelbindungen existieren hier nicht, sondern alle sechs Bindungen sind gleich.
Beim Pyrrol-Molekül dagegen finden wir unterschiedliche Bindungslängen zwischen den Ringatomen: 143 pm zwischen den C-Atomen an Position 3 und 4 sowie nur 137 pm zwischen den C-Atomen an Position 2 und 3 bzw. 4 und 5:
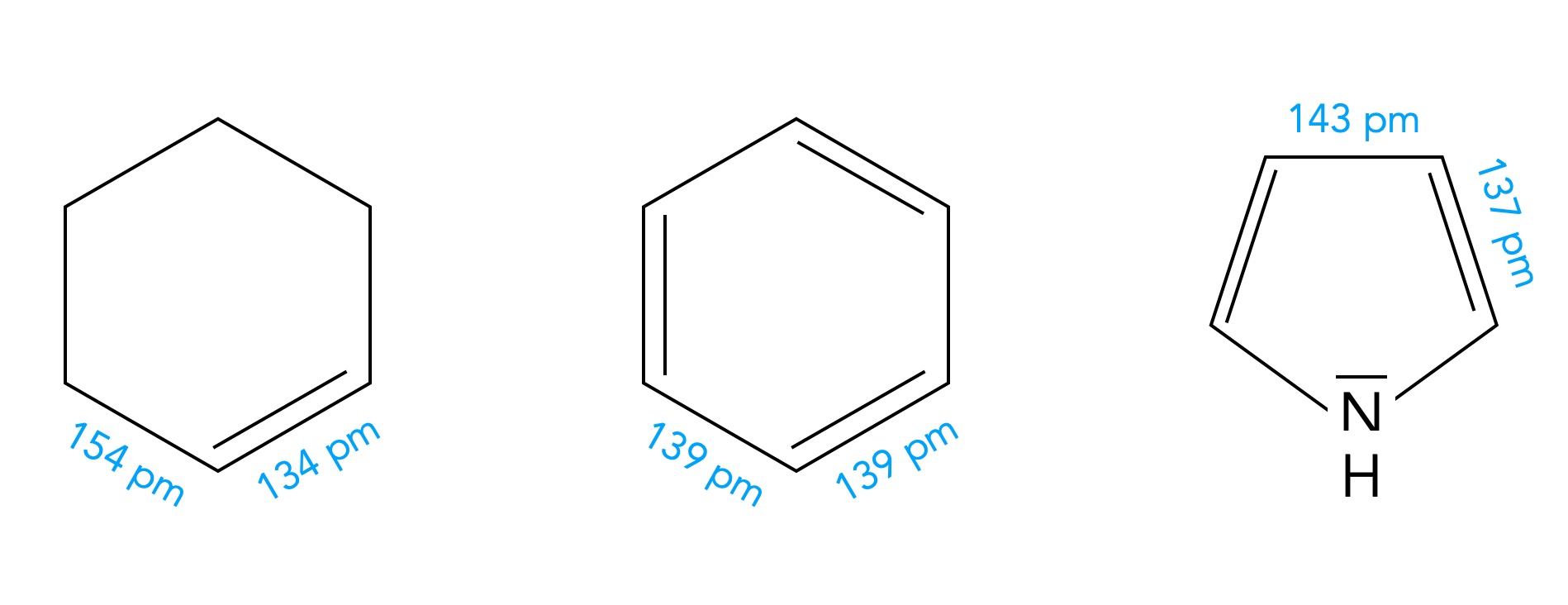
Bindungslängen in Cyclohexen, Benzol und Pyrrol
Autor: Ulrich Helmich 01/2024, Lizenz: siehe Seitenende
Beim Pyrrol-Molekül kann man also schon eher von "Doppelbindungen" sprechen als beim Benzol-Molekül, und teils schlägt sich diese Tatsache auch im chemischen Verhalten der Verbindung nieder. Während Benzol so gut wie keine elektrophile Additionen eingeht, sieht das beim Pyrrol schon anders aus.
Herstellung von Pyrrol
Die industrielle Synthese erfolgt vorwiegend aus Furan. Dieser fünfgliedrige Sauerstoff-Heteroaromat reagiert bei Temperaturen zwischen 300 und 400 ºC mit Ammoniak zu Pyrrol, entsprechende Katalysatoren vorausgesetzt:
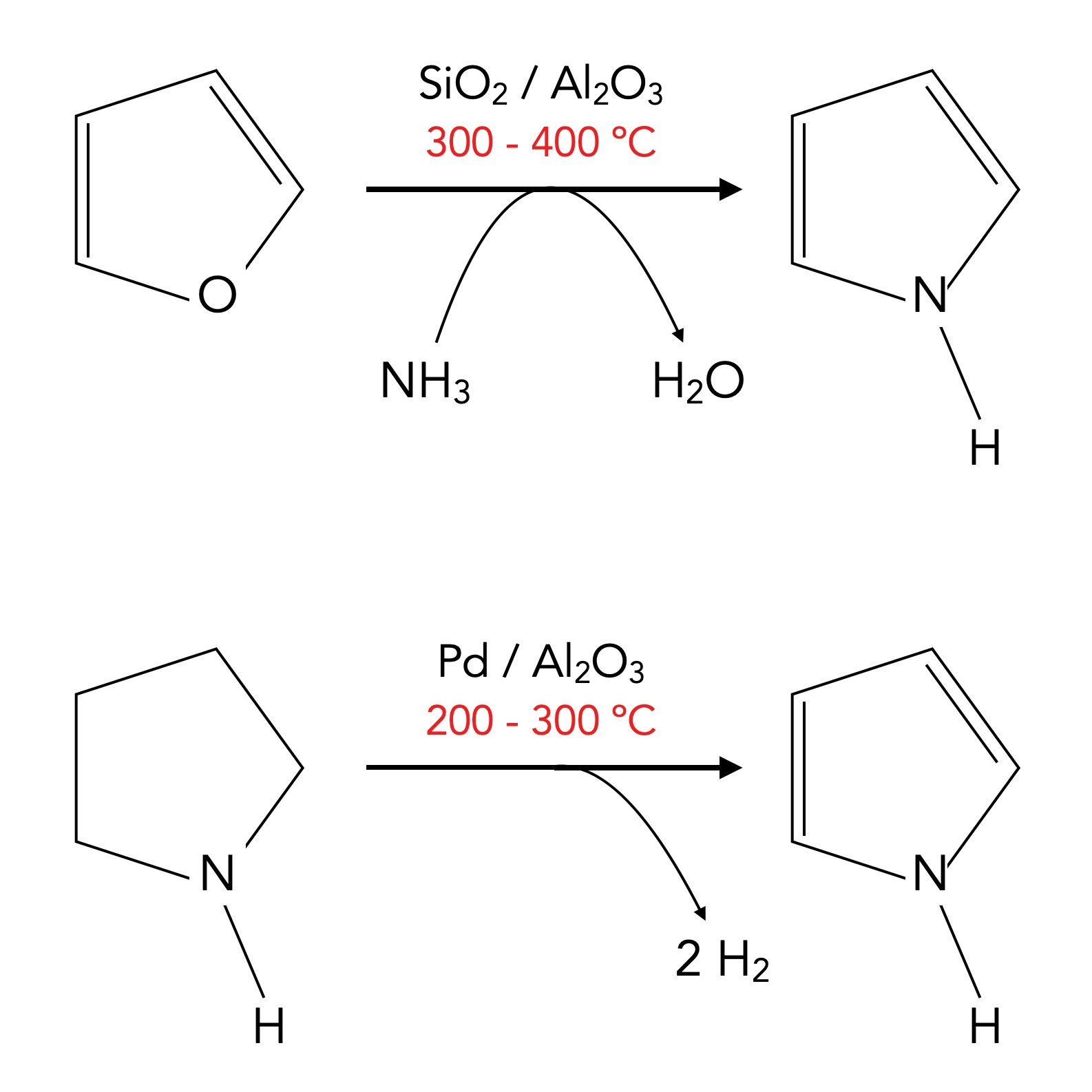
Zwei industrielle Verfahren zur Synthese von Pyrrol
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
Das obige Bild zeigt ein zweites industrielles Verfahren zur Herstellung von Pyrrol, nämlich die Dehydrierung von Pyrrolidin. Dieser nicht-aromatische fünfgliedrige N-Heteroaromat kann leicht aus 1,4-Butandiol gewonnen werden:
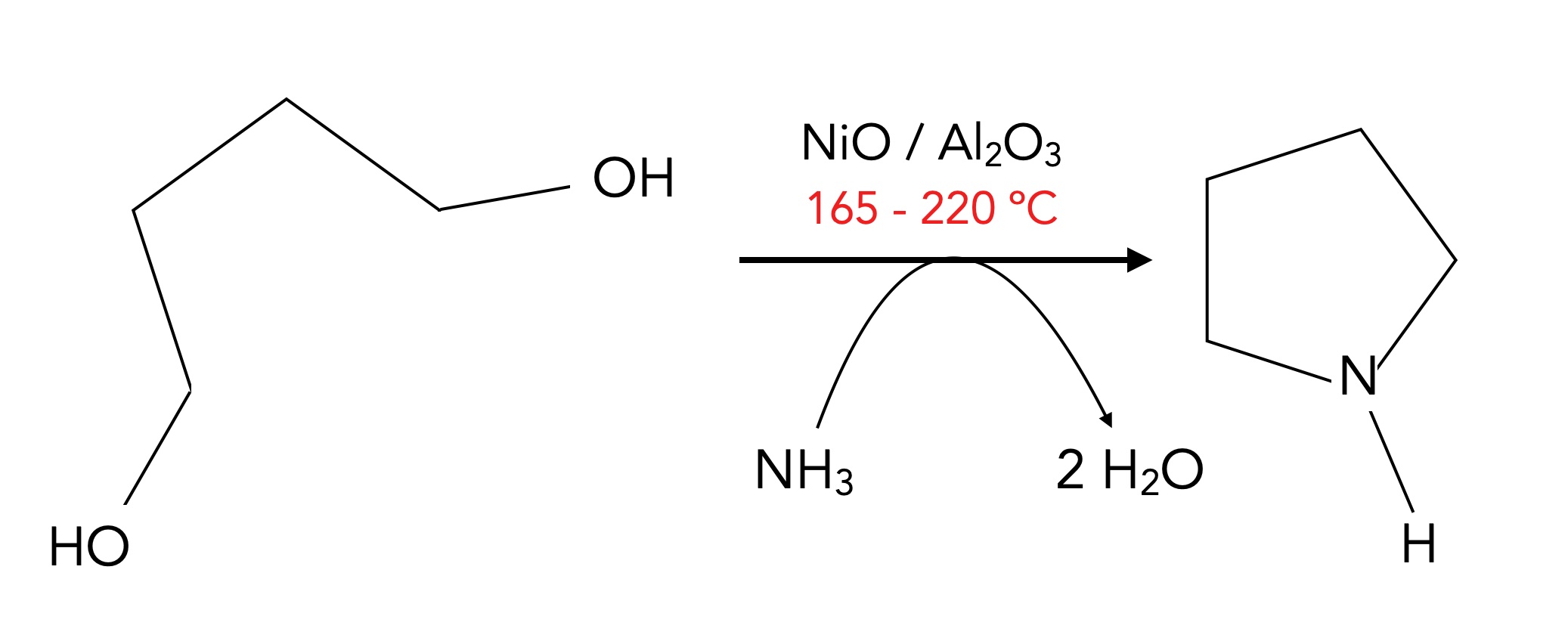
Synthese von Pyrrolidin aus 1,4-Butandiol
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
Ein weiteres industrielles Verfahren ist die Synthese von Pyrrol aus der Verbindung 2-Butin-2,4-diol, einem Butin mit zwei OH-Gruppen.
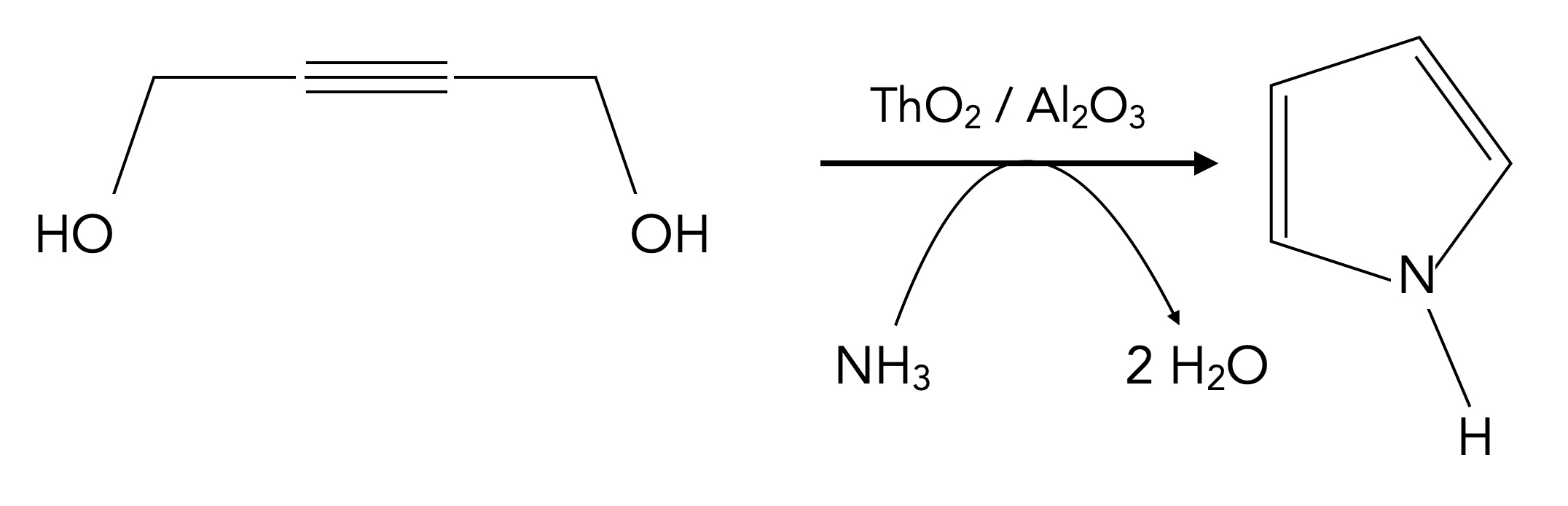
Eine weitere industrielle Methode zur Synthese von Pyrrol
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
Wenn dieses Alkin/Diol mit Ammoniak reagiert (ThO2/Al2O3-Katalysator) entsteht unter Freisetzung von 2 H2O Pyrrol.
Reaktionen des Pyrrols
Pyrrol als sehr schwache Base
Das freie Elektronenpaar des N-Atoms ist Bestandteil des aromatischen Systems aus sechs pi-Elektronen (4 π-Elektronen kommen von den vier C-Atomen, 2 π-Elektronen stellt das N-Atom in seinem pz-Orbital zur Verfügung). Für basische Reaktionen steht es daher so gut wie nicht zur Verfügung. Sollte dennoch einmal eine Protonierung des N-Atoms gelingen, wird dadurch sofort die Aromatizität aufgehoben. Das hypothetische Pyrrolium-Kation wird nämlich nicht durch Mesomerie stabilisiert.
Pyrrol ist daher eine äußerst schwache Base mit einem KB-Wert von ca. 2,5 * 10-14. In einem stark sauren Medium findet zwar eine Protonierung des Pyrrol-Moleküls statt, jedoch nicht am N-Atom, sondern an einem der C-Atome. Die vom Proton mitgebrachte positive Ladung ist dann über den ganzen Ring delokalisiert.
Pyrrol als Säure
Eine Deprotonierung des N-Atoms kann dagegen relativ leicht stattfinden, Pyrrol verhält sich dann wie eine Brönsted-Säure. Das entstandene Pyrrolid-Anion wird durch fünf Grenzstrukturen stabilisiert und ist weiterhin aromatisch.
Elektrophile Substitution
Was elektrophile Substitutionsreaktionen angeht, ist Pyrrol deutlich reaktiver als Benzol:
"Pyrrol stellt den Prototyp eines 'pi-Überschuß'-Hetarens dar; elektrophile Substitutionsreaktionen der ringständigen H-Atome ... spielen deshalb die Hauptrolle. Aufgrund der größeren Elektronendichte des pyrroloiden Systems verlaufen diese Reaktionen schneller als bei benzoiden Verbindungen; die Umsetzungen werden deshalb bei moderaten Temperaturen und oft ohne Zusatz von Katalysatoren durchgeführt". [5]
Eine Erklärung für die größere Elektronendichte könnte die Größe des Pyrrol-Ringes sein. Die sechs π-Elektronen sind auf nur fünf Atome verteilt und nicht auf sechs Atome wie beim Benzol.
Das N-Atom wird nicht elektrophil angegriffen, wohl aber die vier C-Atome an den Positionen 2/5 und 3/4. Die sigma-Komplexe werden durch Mesomerie stabilisiert. Allerdings wird der sigma-Komplex an Position 2/5 durch drei Grenzstrukturen stabilisiert, der sigma-Komplex an Position 3/4 dagegen nur durch zwei Grenzstrukturen. Das N-Atom im Pyrrol ist also ortho-dirigierend, wie man sagt.
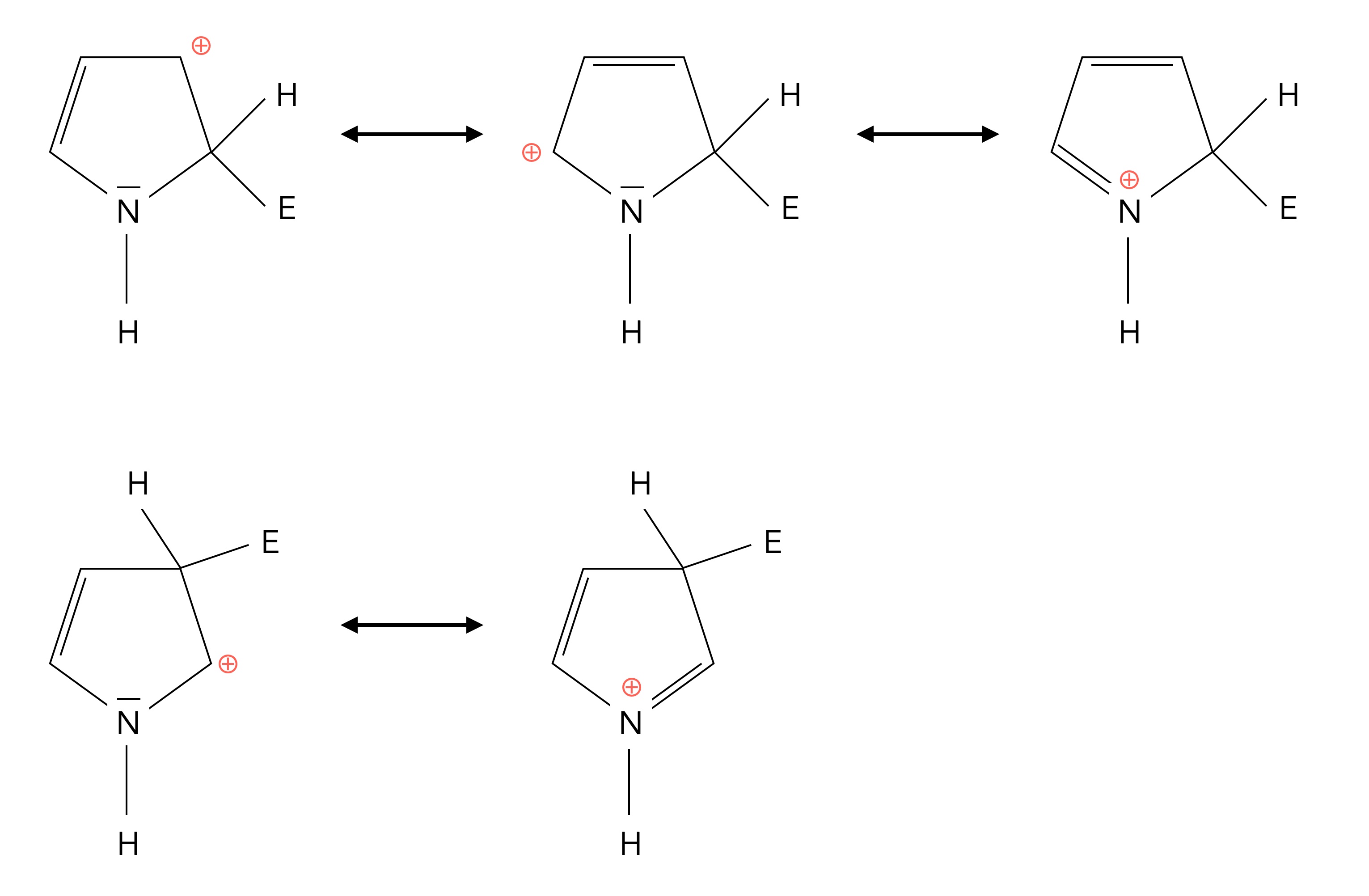
Die Grenzstrukturen der sigma-Komplexe
Autor: Ulrich Helmich 1/2024, Lizenz: siehe Seitenende
Bei der Nitrierung von Pyrrol erhält man zum Beispiel 50% 2-Nitropyrrol und nur 13% 3-Nitropyrrol. Die anderen 37% sind Nebenprodukte.
Nucleophile Substitution
Im Vergleich zu Benzol ist Pyrrol deutlich reaktiver, was die SE angeht. Folgerichtig ist Pyrrol gegenüber der aromatischen SN weniger reaktiv .
Elektrophile Addition
Wie bereits bei der Betrachtung der Bindungslängen gesagt, kann man beim Pyrrol-Molekül eher von "Doppelbindungen" sprechen als beim Benzol-Molekül. Daher geht Pyrrol durchaus - unter bestimmten Bedingungen - elektrophile Additionen ein. Zu nennen ist hier vor allem eine spezielle elektrophile Addition, nämlich die Diels-Alder-Reaktion.
Biologische Bedeutung
Pyrrol ist der Grundbaustein einiger biologisch wichtiger Verbindungen. Vor allem sind hier die Pigmente Chlorophyll und Hämoglobin zu nennen.
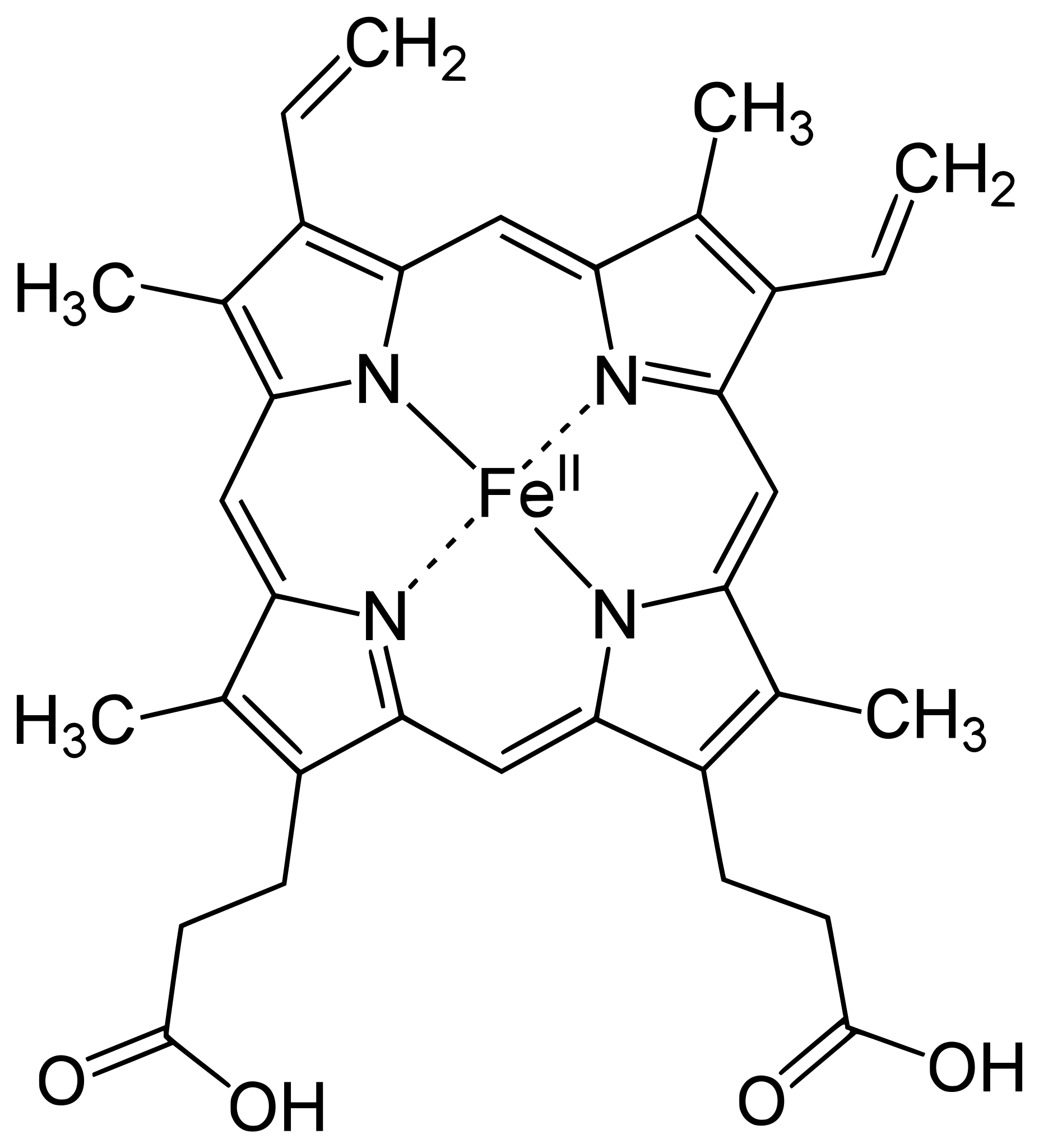
Die Häm-Komponente des Hämoglobins
Yikrazuul, Public domain, via Wikimedia Commons
Die Häm-Komponente ist der farbgebende Nichtprotein-Anteil des Hämoglobins. Sie besteht aus vier Pyrrol-Ringen, die sich um ein Eisen(II)-Atom gruppieren und einen Komplex mit diesem bilden. Der Sauerstoff, der vom Hämoglobin im Blut transportiert wird, wird an das Eisen gebunden.
Das Chlorophyll-Molekül ist ähnlich aufgebaut. Der Nichtprotein-Anteil besteht ebenfalls aus vier Pyrrol-Ringen, allerdings befindet sich hier ein Magnesium-Atom in der Mitte.
Auf dieser Seite für Studienanfänger des Faches Chemie finden Sie vertiefende Informationen zum Pyrrol, auch zu seiner industriellen Herstellung.
Weitere Einzelheiten zum Pyrrol finden sich in diesem Wikipedia-Artikel.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Houben-Weyl, Methoden der Organischen Chemie, Band Hetarenes I, Part 1, 4. Auflage, Stuttgart 1994.