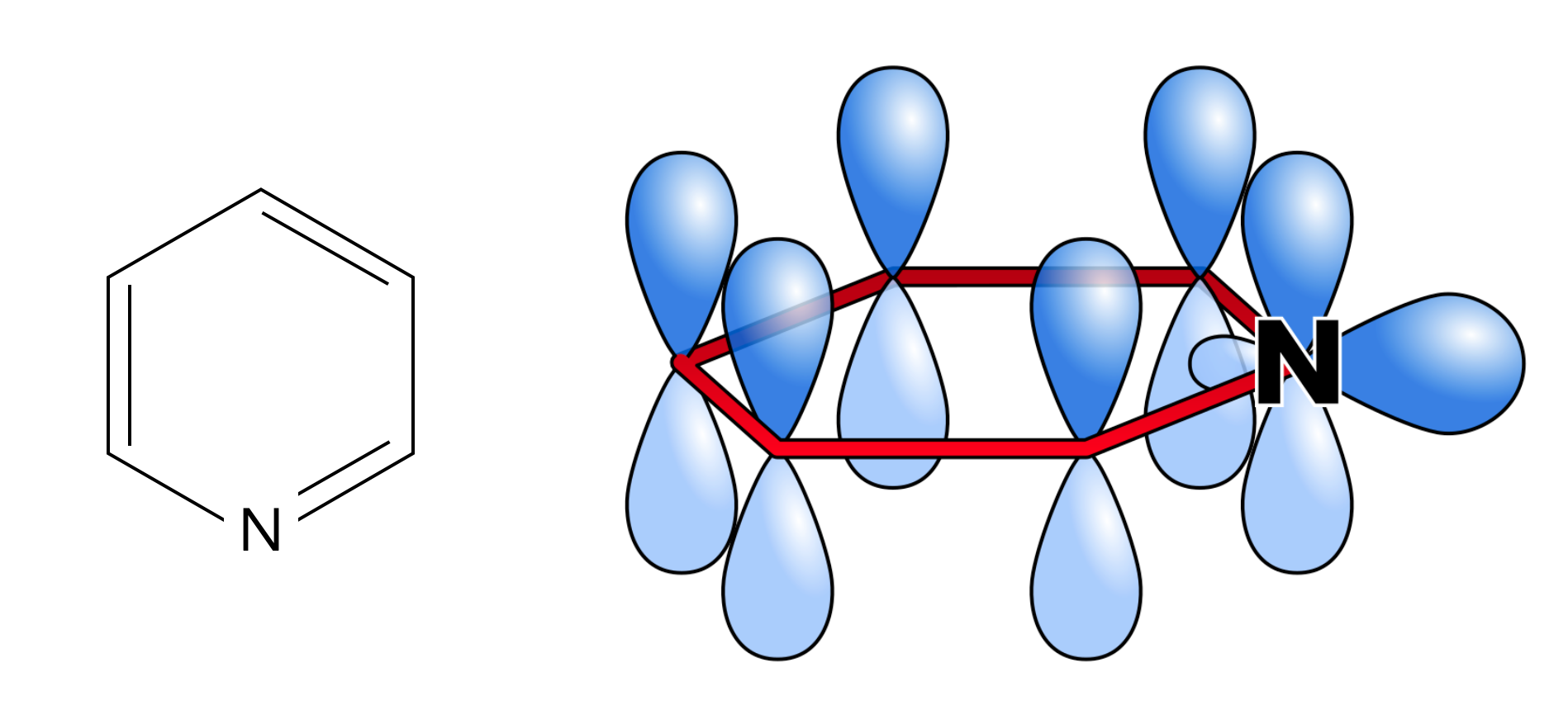
Struktur
Links im Bild sehen wir die Strukturformel, rechts sind die sechs pz-Orbitale der sechs Ring-Atome zu sehen. Auch das Stickstoff-Atom ist sp2-hybridisiert, wie man auf der Zeichnung erkennen kann. Die beiden freien Elektronen des N-Atoms befinden sich nicht im pz-Orbital, sondern im freien sp2-Hybridorbital. Damit wird also die Hückel-Regel (4n+2) mit n=1 erfüllt (6 pi-Elektronen).
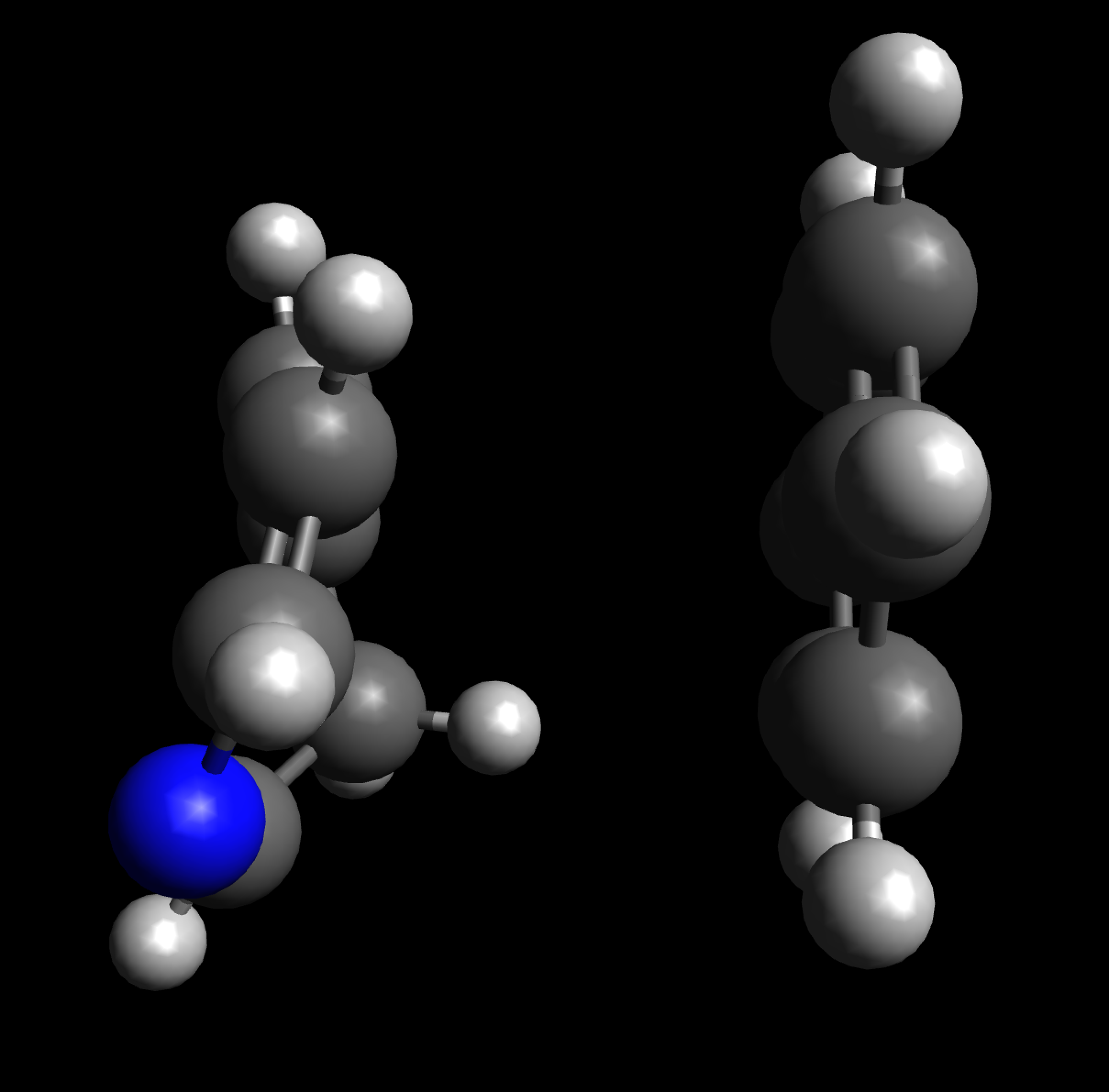
Pyridin und Benzol von der Seite
Autor: Ulrich Helmich 12/2023, Lizenz: CC BY-NC-SA 4.0
Hier sehen wir das Pyridin- und das Benzol-Molekül von der Seite. Beide Modelle wurden am PC mit der Software Avogadro erzeugt. So ganz planar scheint das Pyridin-Molekül nicht zu sein - aber vielleicht hat Avogadro das ja auch nicht korrekt berechnet.
Diese wichtige Regel wurde von Erich Hückel (1896-1980) um 1930 aufgestellt. Mit dieser Regel kann man beurteilen, ob eine cyclische Verbindung mit Doppelbindungen aromatisch ist oder nicht.
Biologische Bedeutung
Pyridin hat abgesehen von seiner starken Giftigkeit keine besondere biologische oder medizinische Bedeutung. Pyridin reizt die Schleimhäute und die Haut sowie den Magen-Darm-Trakt, und es treten gelegentlich neurologische Störungen auf. Wenn man dem Pyridin länger ausgesetzt ist (chronische Exposition), können auch Störungen der Leber- und Nierenfunktion auftreten. Seit 2017 gilt Pyridin auch als "möglicherweise krebserzeugend".
Physikalische und chemische Eigenschaften
Pyridin ist eine farblose Flüssigkeit mit einer Dichte von 0,98 g/cm3, einem Schmelzpunkt von -41,7 ºC und einem Siedepunkt von 115,23 ºC (Daten aus der Wikipedia).
Chemisch relevant ist, dass das freie Elektronenpaar des Stickstoff-Atoms nicht zum aromatischen System gehört. Das hat den "Vorteil", dass sich eine Lewis-Säure an dieses N-Atom anlagern kann, ohne den aromatischen Charakter des Pyridins aufzuheben.
Bei der normalen elektrophilen Substitution lagerte sich ja das Elektrophil kovalent an eines der Ring-C-Atome an, welches dadurch sp3-hybridisiert wurde. Der aromatische Charakter wurde so kurz aufgehoben. Erst durch Abspaltung des H-Atoms wurde das C-Atom wieder sp2-hybridisiert und der aromatische Charakter zurückgebildet.
Aus diesem Grund wird ein elektrophiler Angriff auf das N-Atom begünstigt. Durch den -I-Effekt des N-Atoms ist allerdings die Elektronendichte im Ring verringert, und die C-Atome können nicht so gut elektrophil angegriffen werden wie beispielsweise im Benzol-Molekül. Friedel-Crafts-Alkylierungen oder -Acylierungen sind so gut wie nicht möglich, die Elektrophile würden das N-Atom angreifen, aber nicht die C-Atome.
Durch das elektronenziehende N-Atom ist die Elektronendichte im Ring so gering, dass sogar nucleophile Substitutionen stattfinden können. Vor allem gilt das für Pyridin-Derivate, die gute Abgangsgruppen an ihren C-Atomen tragen.
Weitere Einzelheiten zum Pyridin finden sich in diesem Wikipedia-Artikel.