Herstellung von Chlor
Das Element Chlor begegnet uns im Alltag meistens nur im öffentlichen Schwimmbad, vor allem im Hallenbad. Hier wird das Element als starkes Desinfektionsmittel eingesetzt. Es ist nicht nur für Bakterien tödlich, sondern auch für Tiere und Menschen; daher ist Chlor in der Schule mit äußerster Vorsicht zu behandeln.
Versuch
Synthese von Chlor aus Salzsäure
Durchführung
Die folgende Abbildung zeigt die Apparatur, mit der Chlor in der Schule normalerweise hergestellt wird - natürlich im Abzug.
Was man in der Zeichnung nicht sieht, für das Überleben des Standzylinders aber wichtig ist: Man sollte eine Schicht Seesand in den Standzylinder geben, bevor man das Chlorgas einfüllt und vor allem bevor man den nächsten Versuch mit glühender Eisenwolle durchführt.
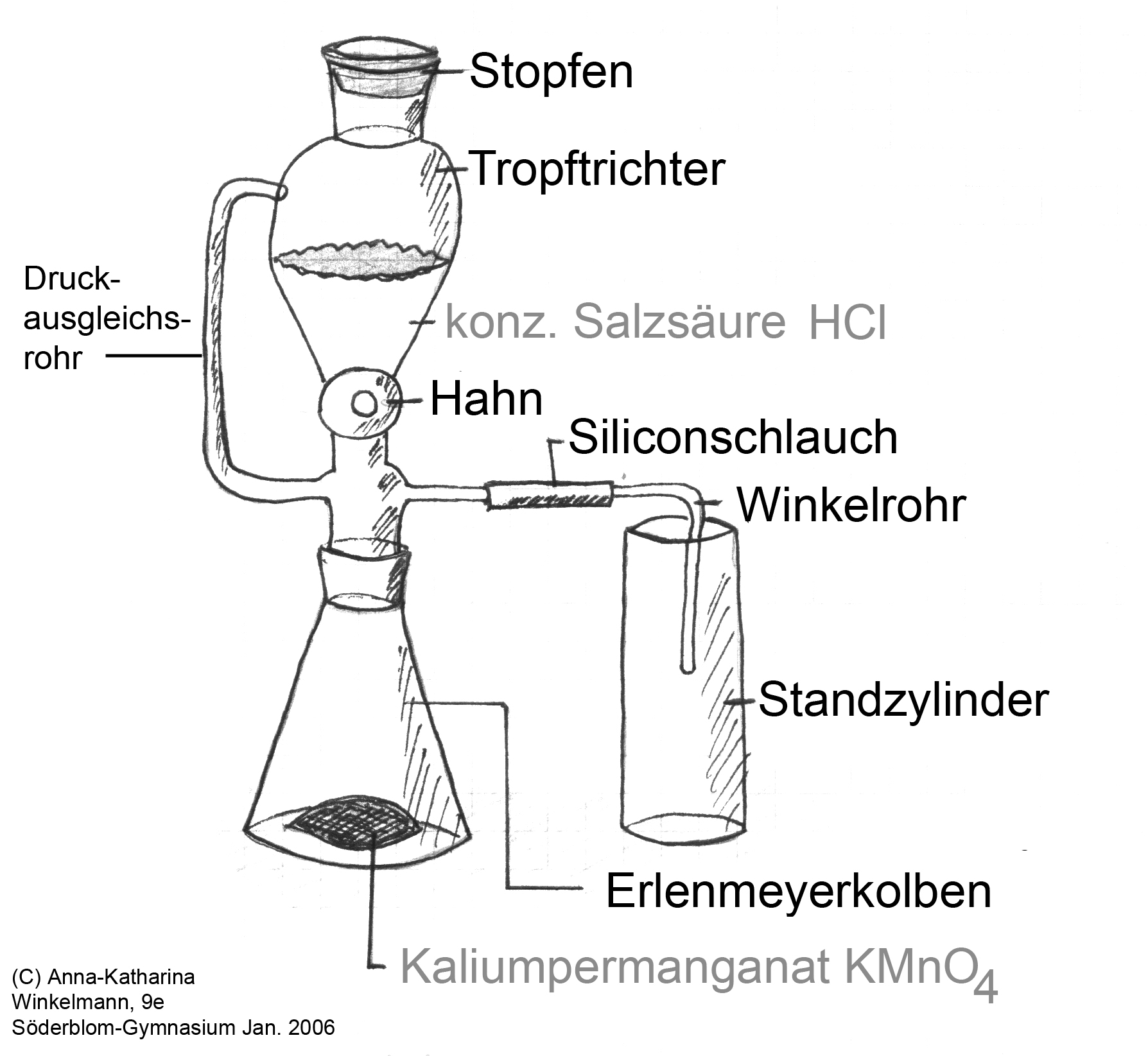
Darstellung von Chlor in einer Gasentwicklungsapparatur aus konz. Salzsäure und Kaliumpermanganat
Beobachtungen:
Wenn der Hahn des Tropftrichters geöffnet wird und die konzentrierte Salzsäure auf das Kaliumpermanganat läuft, fängt es im Erlenmeyerkolben heftig an zu brodeln, man kann sehen, wie ein grünes Gas entsteht und im Erlenmeyerkolben langsam hochsteigt. Schließlich gelangt das Gas über das Winkelrohr in den Standzylinder, wo es aufgefangen werden kann. Wenn der Standzylinder mit Chlorgas gefüllt ist, wird er mit einer Glasplatte möglichst dicht verschlossen.
Erklärungen:
Die bei dieser Synthese ablaufenden chemischen Vorgänge sind für Schüler der Klasse 8 zu komplex, um sie hier zu erklären.
Für Experten:
Es handelt sich um eine Redoxreaktion, bei der das Chlor-Atom der Salzsäure oxidiert und das Mangan-Atom des Kaliumpermanganats reduziert wird.
Versuche mit Chlor
Nachdem wir nun ein wenig Chlor hergestellt haben - die Chemiekollegen, die in der nachfolgenden Stunde Unterricht haben, werden sich freuen, wegen des penetranten Gestanks, der nun im Chemieraum herrscht, obwohl der Versuch im Abzug durchgeführt wurde - wollen wir ein bisschen mit dem Chlor experimentieren, um die wichtigsten Eigenschaften kennenzulernen.
Versuch
Reaktion von Chlor mit Eisen und Kupfer
Durchführung:
Etwas Eisenwolle oder ein kleines Kupferdrahtnetz werden über dem Brenner entzündet; das glühende Metall wird mit der Tiegelzange vorsichtig in den mit Chlorgas gefüllten Standzylinder gegeben.
Beobachtungen:
Man kann eine heftige Reaktion beobachten. Das Metall "verbrennt" unter starkem Aufglühen und noch stärkerer Rauchbildung in dem Chlorgas.
Gibt man nach dem Abkühlen des Zylinders etwas dest. Wasser in den Zylinder und schüttelt kräftig um, bildet sich bei der Verwendung von Eisen eine graubraune Lösung bzw. Suspension des Reaktionsproduktes in Wasser bzw. eine graublaue Lösung/Suspension. Filtriert man diese Lösung/Suspension, so erhält man eine klare braune bzw. blaue Lösung.
Deutung
Bisher haben wir den Begriff "Verbrennung" oder "Oxidation" immer mit Sauerstoff in Verbindung gebracht. Das ist nach diesem Versuch nicht mehr aktuell!
Das Eisen ist in dem Chlorgas "verbrannt", dabei hat sich allerding kein Eisenoxid (Rost) gebildet, sondern die Verbindung Eisenchlorid:
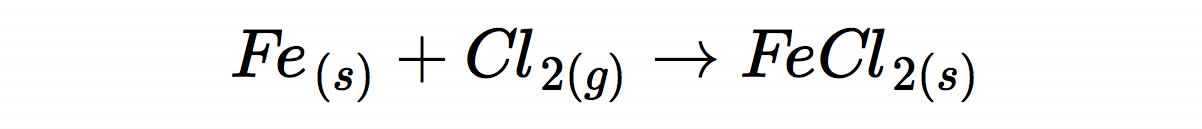
An dem stärkeren Aufglühen / Aufflammen und der Wärmebildung kann man feststellen, dass die Reaktion zudem exotherm verläuft, also unter Abgabe von Energie.
Bei der Reaktion mit Kupfer entsteht das grünblaue Kupferchlorid nach folgender Reaktionsgleichung:
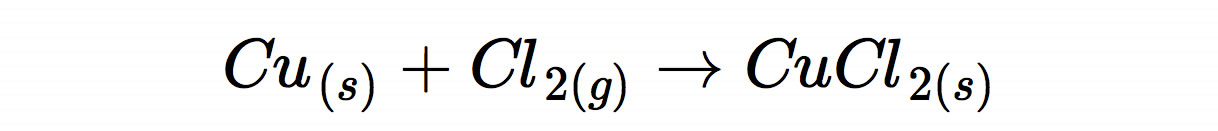
Auf der Seite "Versuch: Chlorgas" der Universität zu Köln kann man sich eine ausführliche Versuchsanleitung mit einer minimalen Gefährdungsbeurteilung herunterladen.
Versuch
Bleichwirkung von Chlor
Durchführung
In einen mit Chlorgas gefüllten Standzylinder werden mit Wasser angefeuchtete bunte Textilien oder rote Blüten gegeben, gut geeignet sind dafür Rosen oder Nelken.
Alternativ kann man auch Chlorwasser für den Versuch verwenden.
Beobachtungen
Nach ein paar Minuten ist eine deutliche Bleichwirkung zu beobachten.
Deutung
Das Chlor zerstört die Farbstoffe, mit denen die Textilien gefärbt sind bzw. die in den Zellen der Blütenblätter enthalten sind.
Für Experten:
Interessanterweise ist es nicht das Chlor selbst, das die Bleichwirkung hat, sondern das Chlor reagiert mit dem Wasser (für den Versuch wurden die Textilien bzw. Blütenblätter ja angefeuchtet) zu Chlorwasserstoff HCl und Sauerstoff. Und zwar nicht zu Sauerstoff-Molekülen O2, sondern zu atomarem Sauerstoff O. Atomarer Sauerstoff hat aber zwei ungepaarte Elektronen (zwei Kugelwolken, die nur mit je einem Elektron besetzt sind), und ist daher sehr reaktiv; es handelt sich um ein Radikal. Sauerstoff-Radikale reagieren aber quasi mit allem, was nicht bei Drei auf den Bäumen ist, auch mit Farbstoffen.
Viele weitere Versuche mit Chlor und anderen Halogenen findet man auf der Seite von Thomas Seilnacht "Demonstrationen zu den Halogenen". Ein Video zur Bleichwirkung von Chlor gibt es auf der Seite der Universität Göttingen, Versuch 20: Chlor als Bleichmittel.
Das Element Chlor
Das Element Chlor ist derart wichtig für den Chemieunterricht, dass ich eine eigene Lexikonseite dafür angelegt habe. Dort finden Sie alle wichtigen Informationen zum Thema Chlor. Noch mehr Informationen finden Sie in den Webseiten, die ich in der rechten Randspalte aufgeführt habe.