Wie kann man organische Moleküle darstellen?
Dazu schauen wir uns mal folgendes Bild an. Es zeigt die Verbindung Butan-1-ol, also einen Alkohol, der sich von dem Alkan Butan ableitet.
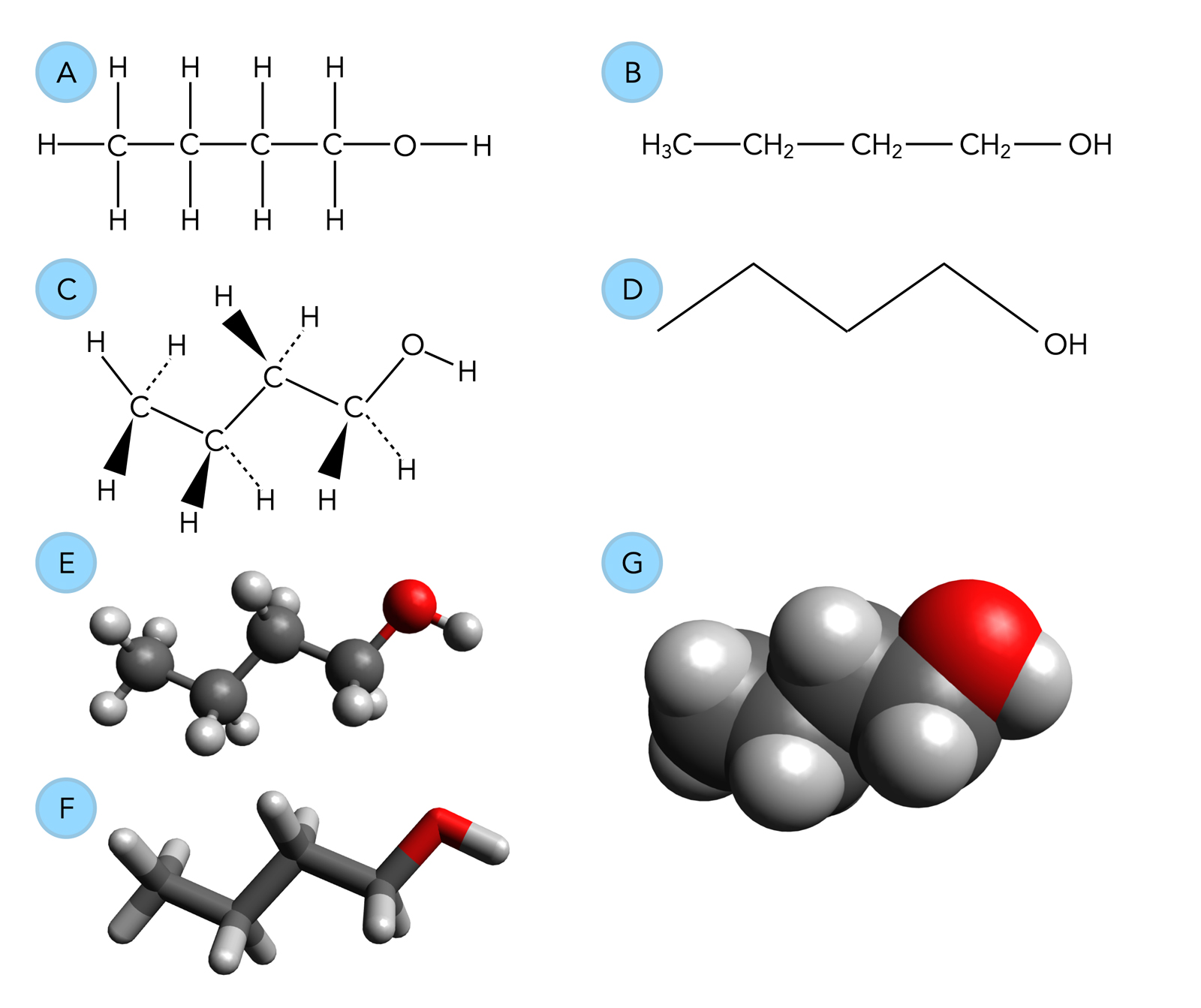
Möglichkeiten zur Darstellung von Butan-1-ol
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei (A) sehen wir die vertraute Strukturformel, wie sie in jedem Schulbuch abgedruckt ist. Die Konstitution des Moleküls (Konstitution = Anordnung der Atome) ist hier sehr genau zu erkennen, und mit einem Lineal kann diese Strukturformel leicht gezeichnet werden. Mit einem Zeichenprogramm ist das schon etwas aufwändiger.
Bei einer Strukturformel handelt es sich um eine Projektionsformel. Man muss sich vorstellen, dass man ein Kugel-Stab-Modell des Moleküls gebaut hat (E), und dass man dann den Schatten nachzeichnet, den dieses Modell auf ein Blatt Papier wirft.
Bei (B) sehen wir die abgekürzte Strukturformel, auch Halbstrukturformel genannt, die leicht per Hand oder mit PC geschrieben werden kann. Auch hier sieht man die Konstitution des Moleküls sehr gut.
(C) ist die Keil-Strich-Formel der Verbindung, eine räumliche Darstellung der Strukturformel. Bindungen, die aus der Papierebene herausragen, werden durch Keile dargestellt, die nach vorn gerichtet sind. Bindungen, aus der Papierebene heraus nach hinten weisen, werden durch gestrichelte Linien oder Keile dargestellt. Nicht nur die Konstitution des Moleküls ist gut zu erkennen, sondern auch die räumliche Anordnung der Atome. Bei (A) und (B) wurde dieser Aspekt nicht berücksichtigt. Der Nachteil dieser Darstellung: Sie ist mit Hand schwer zu zeichnen, und am PC ist die Darstellung noch schwieriger, falls man kein spezielles Programm dafür hat.
(D) ist eigentlich die einfachste Darstellung, man nennt diese Darstellung auch Skelettformel. Kohlenstoff- und Wasserstoff-Atome werden weggelassen, nur die kovalenten Bindungen zwischen diesen Atomen werden durch Striche dargestellt. Jedes Ende und jede Ecke dieser Formel steht für ein C-Atom. H-Atome werden nur gezeichnet, wenn sie entweder eine besondere Rolle spielen (zum Beispiel wenn sie bei einer Säure als Proton abgegeben werden), oder wenn sie Bestandteil einer funktionellen Gruppe sind (zum Beispiel einer OH-Gruppe).
Die Bindungswinkel zwischen den Atomen werden einigermaßen gut wiedergegeben. Die Skelettformel ist extrem leicht von Hand zu zeichnen, und auch am PC sollte das keine Probleme bereiten. Mit Skelettformeln kann man auch sehr komplexe Strukturen übersichtlich darstellen, und auch die Raumgestalt des Moleküls wird einigermaßen gut wiedergegeben, jedenfalls besser als bei den Darstellungen (A) oder (B).
Auf dieser Homepage wird wie auch in vielen guten Büchern hauptsächlich diese Art (D) der Molekül-Darstellung verwendet.
Kommen wir nun zu den Molekülmodellen, die man nicht mehr so einfach mit Hand oder am PC erstellen kann, es sei denn, man hat ein Spezialprogramm wie zum Beispiel Avogadro.
(E) ist das Kugel-Stab-Modell des Butanols. Jedes Atom wird durch eine farbige Kugel dargestellt (Kohlenstoff schwarz, Sauerstoff rot, Stickstoff blau, Chlor grün, Brom braun und Wasserstoff weiß bis hellgrau), und jede kovalente Bindung durch ein Stäbchen. Bei Bindungen zwischen unterschiedlichen Atomen (wie C-O oder O-H) ist jede Hälfte des Stäbchens in der Farbe des benachbarten Atoms gezeichnet.
Die Konstitution des Moleküls ist leicht erkennbar, und auch die Raumgestalt (Bindungswinkel, Bindungslängen, Bindungstyp (Einfach-, Doppel- oder Dreifachbindung)) wird gut wiedergegeben.
(F) ist ein Stab-Modell. Man sieht im Grunde nur die Bindungen zwischen den Atomen, die Atome selbst muss man sich dazu denken. Direkte Vorteile gegenüber (E) sind eigentlich nicht zu erkennen, jedenfalls nicht bei so einfachen Molekülen wie Butanol. Bei komplexen großen Molekülen wie einem Protein mag diese Darstellung ja übersichtlicher sein, aber in der "normalen" organischen Chemie brauchen wir solche Stabmodelle eher weniger.
(G) schließlich ist ein raumfüllendes Kalottenmodell. Hier werden die Elektronenwolken durch große Kugeln dargestellt. Da sich "echte" Elektronenwolken benachbarter Atome durchdringen (kovalente Bindung!), werden auch die Elektronenwolken des Kalottenmodells entsprechend dargestellt. Durch diese Darstellung werden die "wahren Dimensionen" der Atome gut verdeutlicht (genauer gesagt: Die van-der-Waals-Radien). So ungefähr würde das Molekül aussehen, wenn man es mit einem geeigneten Elektronenmikroskop sehen könnte.
Solche raumfüllenden Modelle wie (G) benötigt man beispielsweise wenn man Medikamente entwickelt, die nach dem Schlüssel-Schloss-Prinzip in bestimmte Zell-Rezeptoren hineinpassen müssen, damit sie von den Zellen aufgenommen werden. Dann muss man nämlich die genaue Raumgestalt und -ausdehnung kennen. Auch für bestimmte chemische Reaktionen sind solche Modelle hilfreich, wenn man sehen möchte, welche Teile des einen Moleküls mit Regionen eines anderen Moleküls wechselwirken. Kommt beispielsweise das positive Ende des einen Ausgangsstoffs mit dem negativen Ende eines anderen Ausgangsstoffs in Kontakt, oder können sich diese Pole gar nicht berühren, weil andere Atome im Wege sind? Solche Fragen kann man mit dieser Darstellung klären.
