Drei Säuren im Vergleich
Bei unseren Versuchen mit Salzsäure, Phosphorsäureund Essigsäure der Konzentration 1 mol/l hatten wir gesehen, dass die sauren Lösungen deutlich unterschiedliche pH-Werte hatten, obwohl die Konzentrationen der Lösungen gleich waren. Erklärt hatten wir dieses Phänomen mit dem unterschiedlichen Dissoziationsgrad der drei Säuren: Salzsäure dissoziiert zu ca. 100%, Phosphorsäure zu ca. 10% und Essigsäure zu ca. 1%. Wir hatten daraufhin den Begriff der starken bzw. schwachen Säuren eingeführt: Starke Säuren wie Salzsäure dissoziieren nahezu vollständig in Wasser, während schwache Säuren wie Essigsäure nur zu 1% oder weniger dissoziieren.
Am Ende der Überlegungen hatten wir dann festgestellt, dass diese Einteilung in starke und schwache Säuren recht ungenau ist. In der Fachliteratur werden die Säuren in fünf Stärke-Kategorien eingeteilt: sehr stark, stark, mittelstark, schwach und sehr schwach. Aber auch diese Einteilung ist noch recht ungenau. Auf dieser Seite wollen wir ein präziseres Verfahren kennenlernen, mit der man die Stärke einer Säure angeben kann.
Trotzdem ist das Prinzip dieses genauen Verfahrens das gleiche, wie wir es bereits auf der letzten Seite kennengelernt haben: Man nimmt eine Säure mit einer bekannten Konzentration und misst den pH-Wert dieser sauren Lösung.
Herleitung KS-Wert
Betrachten wir die Protolyse von Ameisensäure-Molekülen HCOOH in Wasser:
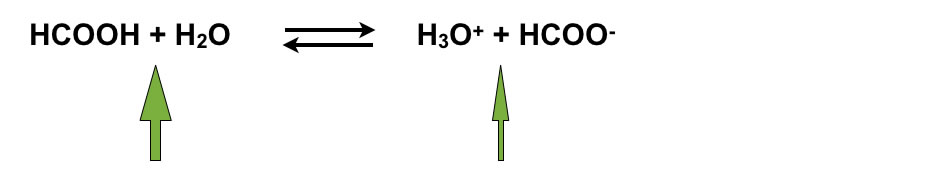
Protolyse der Ameisensäure. Das Gleichgewicht liegt auf der linken Seite.
Das chemische Gleichgewicht dieser Protolyse liegt auf der linken Seite. Solche Protolysegleichgewichte lassen sich am besten mit Hilfe des Massenwirkungsgesetzes beschreiben:
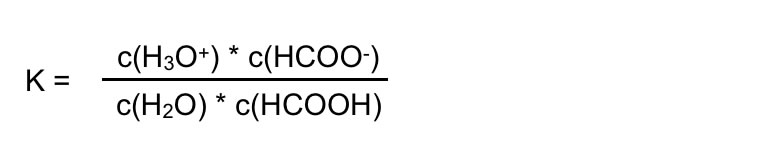
Anwendung des Massenwirkungsgesetzes auf die Protolyse der Ameisensäure
In einer verdünnten Lösung ist die Konzentration der Wasser-Moleküle sehr hoch im Vergleich zu allen anderen Konzentrationen. Daher kann man c(H2O) als konstant ansehen: c(H2O) = 55,55 mol/l.
Für Anfänger:
Wie kommt man auf den Wert c(H2O) = 55,55 mol/l? Ganz einfach: Wasser hat die molare Masse von 18 g/mol, und 1 Liter Wasser sind genau 1000 g. Wenn man 1000 g durch 18 g/mol dividiert, kommt man auf den Wert 55,55 mol. Ein Liter Wasser enthält also genau 55,55 mol Wasser.
Die beiden Konstanten K und c(H2O) können zu einer neuen Konstante KS zusammengefasst werden, der sogenannten Säurekonstante:
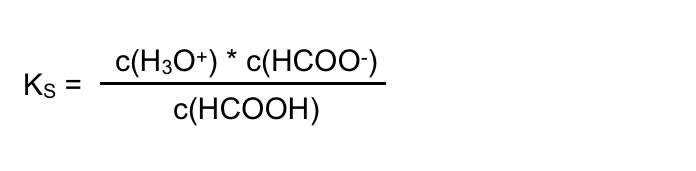
Vereinigung der beiden Konstanten K und c(H2O) zur Säurekonstante KS
Jedes Säure-Molekül, das ein Proton abgibt, hinterlässt genau einen Säure-Rest. Daher gilt die Beziehung
c(H3O+) = c(HCOO-)
und man kann die Gleichung noch etwas vereinfachen:
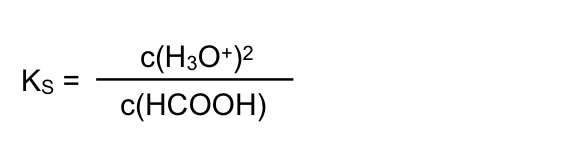
Weitere Vereinfachung der Gleichung
Wenn man diese Gleichung jetzt noch verallgemeinert, so dass sie für alle Säuren gilt, erhält man:
Eine Säure, die zu nahezu 100% dissoziiert, beispielsweise Chlorwasserstoff (Salzsäure), hat einen sehr großen KS-Wert.
Für Anfänger:
Warum haben starke Säuren einen großen KS-Wert? Eine starke Säure dissoziiert zu fast 100%. Im chemischen Gleichgewicht liegen also fast keine Säure-Moleküle mehr vor. Bei der Salzsäure ist dann c(HA) sehr klein. Wenn aber unter dem Bruchstrich ein sehr kleiner Wert steht, heißt das, dass der Bruch selbst einen großen Wert hat. Beispielsweise hat der Bruch 1/0,001 den Wert 1000.
Schwache oder mittelstarke Säuren haben dagegen einen kleinen KS-Wert. Wegen der geringen Dissoziationsrate stehen auf dem Bruchstrich recht kleine Zahlen, während unter dem Bruchstrich eine recht große Zahl steht, da sich die Anfangskonzentration der Säure durch das Auflösen in Wasser kaum verändert hat.
Für Experten:
Eine starke Säure, die zu 100% dissoziiert, hat eigentlich gar keinen KS-Wert. Wenn die Säure tatsächlich zu 100% dissoziiert, ist die Gleichgewichts-Konzentration der Säure gleich Null. Es sind ja keine undissoziierten Säure-Moleküle mehr vorhanden. Durch Null darf man aber bekanntlich nicht dividieren. Also sollte eine starke Säure wie Salzsäure keinen KS-Wert haben.
Trotzdem findet man in der Literatur KS-Werte für starke Säuren. Salzsäure hat beispielsweise den KS-Wert 106, Iodwasserstoffsäure sogar den KS-Wert 1010. Wie kommt man auf solche Werte, wenn man eine Gleichung wie in Abbildung 3 gar nicht verwenden darf, weil c(Säure) = 0 ist?
Ganz einfach: Es gibt ja nicht nur Wasser als Lösungsmittel für Säuren. Auch in anderen Flüssigkeiten, deren Moleküle freie Elektronenpaare an elektronegativen Atomen besitzen, beispielsweise Ethanol, flüssigem Ammoniak etc. können Säure-Moleküle Protonen abgeben. Man bestimmt die Gleichgewichtskonstanten der Protolyse in nichtwässrigen Flüssigkeiten und kann daraus dann KS-Werte für die Säuren berechnen.
Beispiel:
Angenommen, Phosphorsäure dissoziiert in Ethanol zu 0,2 Prozent, Salzsäure aber zu 20 Prozent. Dann weiß man, dass die Salzsäure 100 mal stärker ist als die Phosphorsäure - zumindest in Ethanol. Den KS-Wert von Phosphorsäure kann man leicht bestimmen, da Phosphorsäure in Wasser nicht zu 100% dissoziiert. Nun kann man auch den KS-Wert von Salzsäure berechnen, der dann ja 100 mal größer sein sollte als der von Phosphorsäure.
Schwache Säuren
Schauen wir uns noch einmal die allgemeine Gleichung für den KS-Wert an:
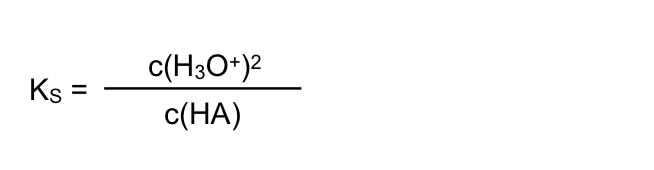
Allgemeine Gleichung für den KS-Wert
Die Konzentration der Oxonium-Ionen kann man leicht über den pH-Wert bestimmen. Wie erhält man aber die Gleichgewichts-Konzentration der Säure? Eine schwache Säure dissoziiert ja nur sehr schwach, vielleicht zu 0,1 Prozent oder noch weniger. Hier kann man folgende Vereinfachung einführen:
Bei schwachen Säuren kann man die Gleichgewichts-Konzentration der Säure mit der Anfangs-Konzentration gleichsetzen!
c(HA) = c0(HA)
Rechenbeispiel:
Eine schwache Säure der Konzentration 0,1 mol/l hat einen pH-Wert von 4,7. Berechnen Sie den KS-Wert dieser Säure.
Wir rechnen: c(H3O+) ist hier 10-4,7. Das Quadrat von c(H3O+) ist dann 10-9,4. Wenn wir diesen Wert durch 10-1 dividieren, erhalten wir 10-8,4. Das ist dann der KS-Wert.
Für Anfänger:
Wenn man zwei Zahlen 10x und 10y multiplizieren will, muss man die Exponenten addieren: 10x * 10y = 10x+y.
Will man die Zahl 10x durch die Zahl 10y dividieren, muss man die Exponenten subtrahieren: 10x / 10y = 10x-y.
Mittelstarke Säuren
Wir wollen jetzt den KS-Wert der Essigsäure berechnen. Essigsäure gehöhrt zu den mittelstarken Säuren. Auch bei mittelstarken Säuren liegt das Protolyse-Gleichgewicht weit auf der linken Seite, allerdings nicht so extrem weit wie bei schwachen Säuren.
Bei schwachen Säuren hatten wir als Vereinfachung eingeführt: c(HA) = c0(HA). Diese Vereinfachung funktioniert bei mittelstarken Säuren nicht mehr. Zwar liegt das Gleichgewicht der Protolyse immer noch weit links, aber dennoch dissoziiert ein merklicher Anteil der Säure-Moleküle, den wir nicht vernachlässigen können.
Der dissoziierte Anteil der Säure-Moleküle entspricht der Konzentration der Oxonium-Ionen, da diese ja das Ergebnis der Dissoziation sind. Also kann man die Konzentration der Oxonium-Ionen von der Ausgangs-Konzentration der Säure abziehen, um die Gleichgewichts-Konzentration der Säure zu erhalten: c(HA) = c0(HA) - c(H3O+).
Damit erhalten wir:
$K_{s}=\frac{c(H_{3}O^{+})^{2}} {c_{0}(HAc) - c(H_{3}O^{+})}$Für die Essigsäure stehen uns folgende Daten zur Verfügung: Essigsäure der Ausgangs-Konzentration c0(HAc) = 0,1 mol/l hat einen pH-Wert von 2,8. Daraus berechnet sich die Konzentration der Oxonium-Ionen zu 10-2.8 mol/l.
Wir setzen nun diese Werte in obige Gleichung ein und erhalten:
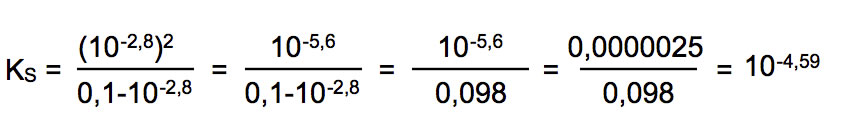
Das Quadrat von 10-2.8 können wir noch im Kopf ausrechnen: 10-5.6, aber die Differenz unter dem Bruchstrich, 0.1 - 10-2.8 müssen wir mit dem Taschenrechner berechnen: 0.098. Wenn wir dann 10-5.6,durch 0.098 dividieren, erhalten wir als KS-Wert 10-4,59.
Hätten wir stattdessen einfach - wie bei schwachen Säuren - die Ausgangs-Konzentration c0(HAc) = 0,1 mol/l eingesetzt, hätte sich ein leicht abweichender Wert von 10-4,60 ergeben, also im Prinzip das Gleiche. Aus diesem Grund darf man auch bei mittelstarken Säuren diese zweite Vereinfachung machen, dass man also als Gleichgewichts-Konzentration der Säure die Ausgangs-Konzentration einsetzt.
Der pKS-Wert
Die KS-Werte der verschiedenen Säuren schwanken sehr stark. Starke Säuren haben KS-Werte im Bereich 106 oder 1010, schwache Säuren KS-Werte im Bereich 10-6, 10-12 oder sogar 10-35. Wie immer in solchen Fällen bevorzug man eine logaritmische Angabe, und so kommt man vom KS-Wert zum pKS-Wert.
Der pKS-Wert ist der negative dekadische Logarithmus des KS-Wertes.
Auf der Seite "Säurekonstante" der Wikipedia findet sich eine Tabelle mit den pKS-Werten der wichtigsten Säuren. Hier ein kleiner Auszug aus dieser Tabelle:
- Iodwasserstoff: -10
- Bromwasserstoff: -8,9
- Chlorwasserstoff: -6
- Schwefelsäure: -3
- Salpetersäure: -1,34
- Phosphorsäure: 2,13
- Fluorwasserstoff: 3,14
- Ameisensäure: 3,75
- Essigsäure: 4,75
- Kohlensäure: 6,52
- Schwefelwasserstoff: 6,92
- Blausäure: 9,4
- Wasser: 14
- Ethanol: 15,9
- Ammoniak: 23
- Methan: 48
Ein pKS-Unterschied von 1 bedeutet, dass die Vergleichssäure 10 mal stärker bzw. schwächer ist. So ist Ameisensäure 10 mal stärker als Essigsäure, während Ethanol eine 100 mal schwächere Säure ist als Wasser.
Nivellierender Effekt
Schwefelsäure wäre nach dieser Tabelle 1000 mal schwächer als gleichkonzentrierte Salzsäure, und Salpetersäure sogar mehr als 10.000 mal schwächer als Salzsäure.
Jeder, der sich schon einmal mit Schwefelsäure oder Salpetersäure verätzt hat, weiß, dass diese Berechnungen nicht stimmen können. Schwefelsäure ist NICHT 1000 mal schwächer als Salzsäure, sondern fast genau so stark - zumindest was das Verhalten gegenüber Metallen, Kalk und Haut angeht. Alle starken bzw. sehr starken Säuren dissoziieren in Wasser zu nahezu 100%. Dem Metall, dem Kalk oder der Haut ist es völlig egal, ob die Oxonium-Ionen, die ja für die Säurewirkung verantwortlich sind, aus Schwefelsäure oder Salzsäure stammen. Eine 1-molare Lösung von Chlorwasserstoff enthält genau so viele Oxonium-Ionen wie eine 0,5-molare Lösung von Schwefelsäure (Schwefelsäure ist zweiprotonig!). Der Säure-Effekt sollte also der gleiche sein, unabhängig vom pKS-Wert. Hier spricht man auch vom nivellierenden (ausgleichenden) Effekt des Wassers. Die unterschiedlichen pKS-Werte von Salzsäure (eigentlich: Chlorwasserstoff) und Schwefelsäure beruhen auf dem Verhalten dieser Säuren in nichtwässrigen Lösemitteln (siehe Expertenkasten), wo sie nicht zu 100% dissoziieren.