
pH-Berechnung bei starken Säuren
Die Berechnung des pH-Wertes bei einer starken Säure ist einfach: Eine starke Säure dissoziiert zu 100%, die Konzentration der Oxonium-Ionen c(H3O+) ist also genau so groß wie die Anfangs-Konzentration c0(HA) der Säure:
c(H3O+) = c0(HA)
Eine 0,01-molare Salzsäure hat demnach einen pH-Wert von 2, denn c(H3O+) = c0(HCl) = 0,01 mol/l = 10-2 mol/l.
Bei starken Säuren kann man den pH-Wert aus der Ausgangskonzentration c0(HA) der Säure leicht berechnen.
Der Begriff "Ausgangskonzentration" ist bei starken Säuren etwas irreführend, denn die Konzentration einer starken Säure ändert sich nicht mehr, sie ist ja bereits von Anfang an vollständig dissoziiert. Bei schwachen Säuren macht dieser Begriff etwas mehr Sinn, da sich hier erst (in extrem kurzer Zeit) ein chemisches Gleichgewicht einstellt, und die Gleichgewichts-Konzentration kann dann von der Anfangskonzentration abweichen.
Rechenbeispiel
Berechnen Sie den pH-Wert einer 0,3-molaren Lösung von HCl.
Wir tippen in den Taschenrechner den Wert 0,3 ein und ziehen dann den dekadischen Logarithmus: -0,5229. Der negative dekadische Logarithmus ist dann der pH-Wert: pH=0,523
pH-Berechnung bei schwachen Säuren
Hier wird es etwas komplizierter. Die Säure-Moleküle dissoziieren so gut wie nicht. Daher ist die Zahl der Oxonium-Ionen wesentlich geringer als die Zahl der nicht dissoziierten Säure-Moleküle. Für die Gleichgewichts-Konzentration der Oxonium-Ionen in der Lösung einer schwachen Säure gilt daher:
c(H3O+) << c0(HA)
Also kann man nicht einfach die Ausgangskonzentration der Säure nehmen und daraus den pH-Wert berechnen.
Aber es gibt eine schöne Vereinfachung, die man sich zu nutze machen kann. Wenn so gut wie kein Säure-Molekül dissoziiert, kann man die Gleichgewichts-Konzentration der Säure mit der Anfangskonzentration gleichsetzen:
c(HA) = c0(HA)
Die aus dem Massenwirkungsgesetz hergeleitete Gleichung verändert sich dann zu:
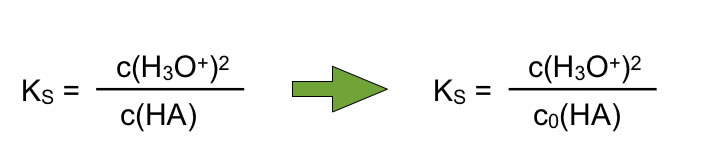
Vereinfachung bei schwachen Säuren: c(HA) = c0(HA)
Wenn wir jetzt aus der Anfangskonzentration den pH-Wert der Säure berechnen wollen, müssen wir die Gleichung umstellen, so dass sich c(H3O+) auf der linken Seite der Gleichung befindet:
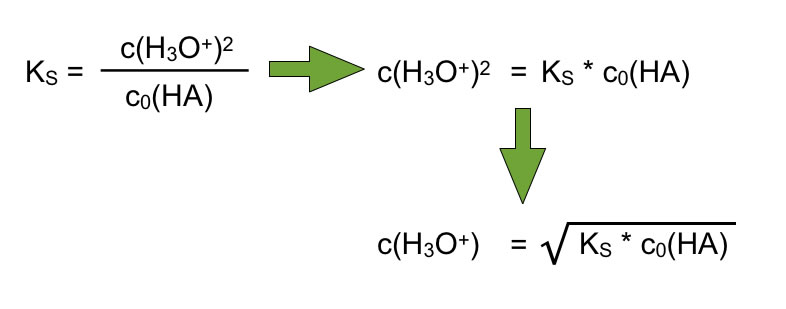
Berechnung der Oxoniumionen-Konzentration bei einer schwachen Säure
Wir müssen also den KS-Wert der Säure, den wir in einer geeigneten Tabelle (oder im Internet) nachschlagen, mit der Anfangskonzentration der Säure multiplizieren und dann die Wurzel aus dem Produkt ziehen. Dann erhalten wir die Gleichgewichts-Konzentration der Oxonium-Ionen, und daraus dann den pH-Wert dieser sauren Lösung.
Rechenbeispiel 1:
Berechnen Sie den pH-Wert einer 0,1-molaren Blausäure HCN. Blausäure hat den pKS-Wert 9,4.
Wir können den pH-Wert sogar ohne Taschenrechner bestimmen. Unter dem Wurzelzeichen steht der Ausdruck
10-9,4 * 10-1
Das können wir im Kopf zusammenrechnen zu
10-10,4
Mathematik-Nachhilfe:
Wenn man zwei Zahlen 10x und 10y multiplizieren will, muss man die Exponenten addieren: 10x * 10y = 10x+y
Will man die Wurzel einer solchen Zahl ziehen, muss man den Exponenten halbieren. Die Wurzel von 106 ist zum Beispiel 103.
Die Wurzel aus diesem Wert kann man ebenfalls noch im Kopf ausrechnen, und schon hat man die Konzentration der Oxonium-Ionen:
c(H3O+) = 10-5,2 mol/l
Daraus ergibt sich dann ein pH-Wert von pH=5,2.
Für Experten:
Wenn wir den pH-Wert für die zehnmal so konzentrierte 1-molare Lösung der Blausäure ausrechnen, kommen wir auf pH=4,7.
An sich hatten wir doch einmal gelernt, dass eine zehnfache Verdünnung den pH-Wert um genau eine Einheit verändert. Eine 1-molare Salzsäure hat den pH-Wert 0, eine 0,1-molare Salzsäure den pH-Wert 1. Offensichtlich gilt diese Beziehung nur für starke Säuren, die vollständig dissoziieren. Bei der schwachen Blausäure steigt der pH-Wert bei einer zehnfachen Verdünnung nur von 4,7 auf 5,2.
Rechenbeispiel 2:
Berechnen Sie den pH-Wert einer 0,06-molaren Kohlensäure. Kohlensäure hat den pKS-Wert 6,52.
Unter dem Wurzelzeichen steht der Ausdruck
10-6,52 * 10-?
Den Exponenten der zweiten Zahl (Konzentration) müssen wir mit dem Taschenrechner bestimmen. Dazu tippen wir 0,06 in den Taschenrechner ein und ermitteln dann den dekadischen Logarithmus. Der dekadische Logarithmus von 0,06 ist -1,222. Jetzt können wir den Wurzelausdruck vervollständigen, dabei vernachlässigen wir die letzte Stelle des Logarithmus-Wertes:
10-6,52 * 10-1,22
Den Rest können wir wieder im Kopf berechnen. Das Produkt unter dem Wurzelzeichen ist
10-6,52 + (-1,22) = 10-7,74
Die Hälfte von 7,74 ist 3,87. Also gilt:
c(H3O+) = 10-3,87 mol/l
Daraus ergibt sich dann ein pH-Wert von pH=3,87.
Rechenbeispiel 3:
Berechnen Sie den pH-Wert einer 1,4-molaren Ameisensäure.
Zunächst recherchieren wir im Internet (oder in einer Tabelle, falls zur Hand) nach dem pKS-Wert von Ameisensäure bzw. Methansäure. Die Wikipedia liefert uns den Wert 3,77.
Mit dem Taschenrechner ermitteln wir den dekadischehn Logarithmus der Konzentration: log10(1,4) = 0,146.
Diese Werte setzen wir nun in den Ausdruck unter dem Wurzelzeichen ein:
10-3,77 * 100,146 = 10-3,624
Beim Ziehen der Quadratwurzel halbieren wir den Exponenten und erhalten -1,812. Und wenn wir jetzt das Minuszeichen weglassen, haben wir bereits den pH-Wert der sauren Lösung: pH = 1,812.
Säure und saure Lösung
Beim Lesen dieses Textes haben sie sich vielleicht schon gefragt, warum an manchen Stellen von einer Säure die Rede ist, an anderen Stellen aber von einer sauren Lösung. Hier noch einmal eine Klarstellung für alle, denen der Unterschied noch nicht klar ist:
Säure = unverdünnte, reine Säure.
saure Lösung = eine Lösung dieser Säure in dest. Wasser.
Salzsäure beispielsweise ist streng genommen keine Säure, sondern die saure Lösung der Säure Chlorwasserstoff HCl. Wenn man reine Essigsäure (also die 99%ige oder 100%ige) in ein Becherglas mit dest. Wasser gibt und dann den pH-Wert misst, dann ermittelt man nicht den pH-Wert von Essigsäure, sondern den pH-Wert der sauren Lösung von Essigsäure.
pH-Wert von mittelstarken Säuren
Für das Chemie-Abitur in NRW reicht es völlig aus, wenn wir auch bei einer mittelstarken Säure das Verfahren bzw. die Gleichung für schwache Säuren verwenden.