Als "starke chemische Bindungen" bezeichnet man die aus dem Chemieunterricht bekannten intramolekularen Bindungen, also die Bindungen innerhalb eines Moleküls, Salzkristalls oder Metalls.
Intramolekulare Bindungen
Starke chemische Bindungen sind die Bindungen innerhalb eines Moleküls, Metalls oder Salzkristalls, sie werden daher auch als intramolekulare Bindungen bezeichnet.
Intramolekulare Bindungen = Bindungen innerhalb eines Moleküls, Metalls oder Salzkristalls. Man unterscheidet hier kovalente Bindungen (= Elektronenpaarbindungen), Metallbindungen und Ionenbindungen sowie Zwischenformen. Diese drei Bindungsarten werden auch als starke chemische Bindungen bezeichnet.
Davon zu unterscheiden sind die schwachen chemischen Bindungen, die auch als intermolekulare Bindungen bezeichnet werden. "Intermolekular" heißt, dass die Bindungen zwischen den Molekülen bestehen, und nicht innerhalb eines Moleküls. Bei den zwischenmolekularen Bindungen unterscheidet man die Wasserstoffbrücken-Bindungen und die van-der-Waals-Bindungen. Wir wollen uns auf dieser Seite aber mit den intramolekularen Bindungen beschäftigen. Betrachten wir dazu doch einmal das folgende Bild:
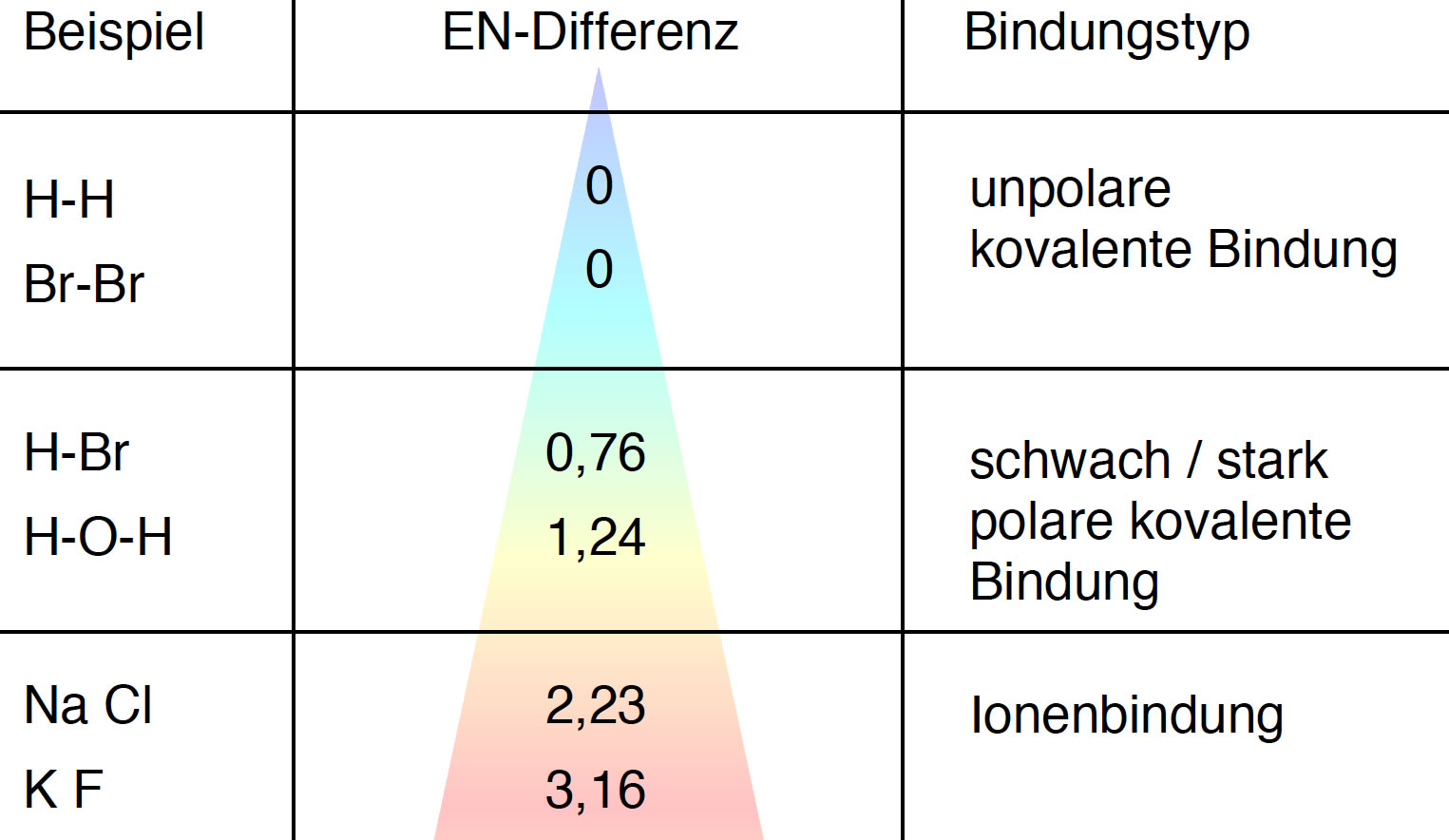
Abhängigkeit der chemischen Bindung von dem EN-Unterschied der Atome
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Dieses Bild soll zeigen, dass die Art der intramolekularen Bindung zwischen zwei Atomen stark von der Elektronegativität der beiden Atome abhängt, genauer gesagt, von der Differenz der Elektronegativitäten.
Unpolare kovalente Bindung
Haben die beiden Atome einer chemischen Bindung die gleiche oder eine sehr ähnliche Elektronegativität, dann bildet sich eine unpolare kovalente Bindung aus. Das ist zum Beispiel in den Wasserstoff-Molekülen H2, Sauerstoff-Molekülen O2, Brom-Molekülen Br2, aber auch in organischen Molekülen wie CH4 der Fall.
Polare kovalente Bindung
Liegt die EN-Differenz zwischen ca. 0,76 und 1,24, dann entsteht ebenfalls eine kovalente Bildung, allerdings eine schwach bis stark polare kovalente Bindung. Solch eine Bindung haben wir beispielsweise im Wasser-Molekül zwischen den Sauerstoff- und Wasserstoff-Atomen oder im Bromwasserstoff-Molekül zwischen Brom und Wasserstoff.
Ionenbindung
Ab einer EN-Differenz von 2,23 ist die chemische Bindung derart polar, dass sich die Bindungselektronen nicht mehr bevorzugt in der Nähe des elektronegativeren Atoms aufhalten, sondern komplett. Das elektropositivere Element gibt seine Außenelektronen komplett ab, und das elektronegativere Element füllt seine Außenschale komplett mit diesen Elektronen auf. Das ist bei den typischen Salzen wie Natriumchlorid oder Kaliumfluorid so. Hier sprechen wir dann nicht mehr von einer extrem polaren kovalenten Bindungen, sondern von einer Ionenbindung.
Zwischenformen
Zwischen der polaren kovalenten Bindung der und der Ionenbindung gibt es auch noch Übergangsformen, zum Beispiel beim Alumiumbromid. AlBr3 ist kein klassisches Salz mehr, sondern liegt in Form von Molekülen vor, deren Bindungen aber extrem polar sind.
Metallische Bindung
Sind beide Atome recht elektropositiv, wie das bei Metall-Atomen der Fall ist, haben wir es mit einem neuen Bindungstyp zu tun, der in der obigen Abbildung nicht mit berücksichtigt ist, nämlich die metallische Bindung. Jedes Atom des Metalls gibt seine Außenelektronen ab, und sämtliche abgegebenen Elektronen bilden ein sogenanntes Elektronengas, das sich mehr oder weniger frei zwischen den positiven Atomrümpfen bewegt. Das erklärt dann auch die elektrische Leitfähigkeit der Metalle. Legt man eine Spannung an das Metall an, dann ziehen sich die frei beweglichen Elektronen zum positiven Pol hin.