Drei Stoffe

Wir sehen hier drei Stoffe: 18 g Wasser, 32 g Schwefel und 64 g Kupfer.
Was haben diese drei Stoffe gemein? Die erste Vermutung, dass es sich um drei Elemente handelt, ist falsch, denn Wasser ist ja bekanntlich eine Verbindung. Auch drei Feststoffe sind es nicht, denn einer der Stoffe ist flüssig. Die gleiche Masse oder das gleiche Volumen haben die drei Stoffe auch nicht. Was also ist das Gemeinsame der drei Stoffe?
Alle drei Stoffe bestehen aus der gleichen Anzahl von Teilchen. Der Schwefel enthält 6,022 * 1023 Schwefelatome, das Kupfer 6,022 * 1023 Kupferatome, und das Wasser 6,022 * 1023 Wassermoleküle.
Relative Atommassen
Zur Zeit DALTONs fing man an, systematische Experimente mit Elementen und Verbindungen durchzuführen. Sehr schnell erkannte man, dass die Gesamtmasse der Stoffe bei chemischen Reaktionen erhalten bleibt (1. Massengesetz von der "Erhaltung der Masse"). Bald darauf stellte man fest, dass zwei Elemente stets im gleichen Massenverhältnis miteinander reagieren. Kupfer und Schwefel reagieren beispielsweise stets im Massenverhältnis 4 : 1 miteinander, wenn Kupfersulfid entsteht.
Beispiel Kupfer und Schwefel
Zunächst glaubte man, dass sich immer ein Kupfer-Atom mit einem Schwefel-Atom verbindet. Dann müsste ein Kupfer-Atom genau viermal so "schwer" sein wie ein Schwefel-Atom. Später fand man aber heraus, dass sich immer zwei Kupferatome mit einem Schwefelatom verbinden. Daraus schloss man logisch, dass ein Kupfer-Atom genau doppelt so schwer ist wie ein Schwefel-Atom.
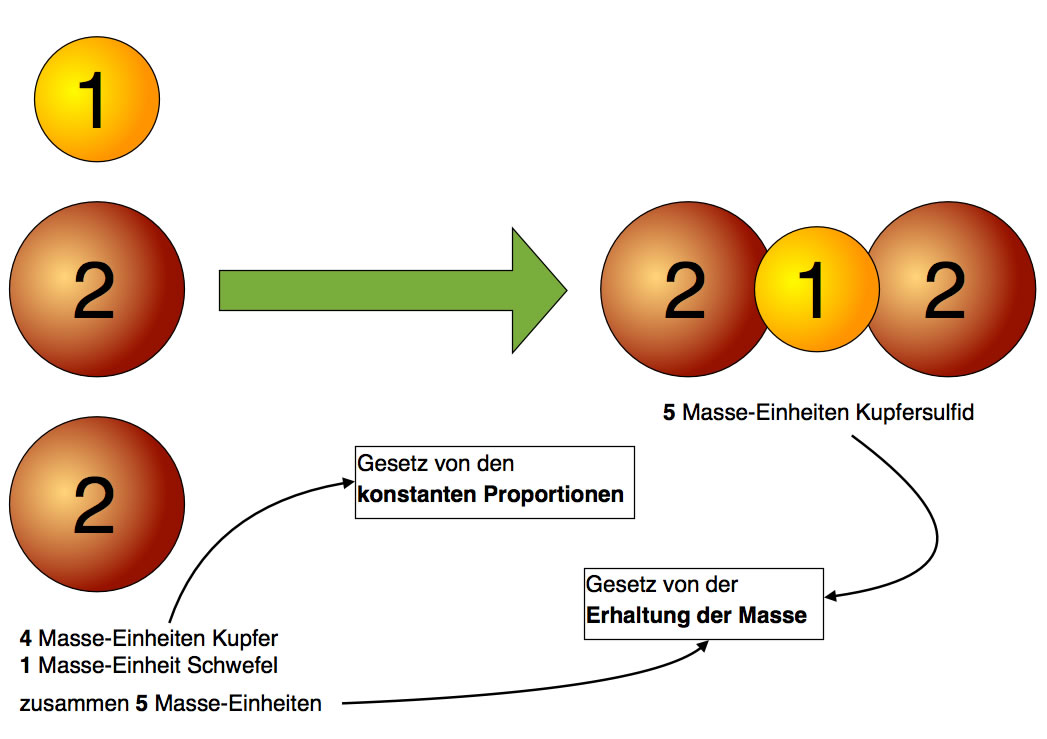
Diese schematische Graphik zeigt noch einmal, wie sich zwei Kupfer-Atome mit einem Schwefel-Atom zu einer Kupfersulfid-Einheit verbinden.
Für Fortgeschrittene: Kupfersulfid ist eine Ionenverbindung, daher kann man hier nicht von Kupfersulfid-Molekülen sprechen. In dem Ionenkristall kommen aber auf jedes Sulfid-Ion zwei Kupfer-Ionen.
Was wusste man nun?
Eigentlich noch nicht sehr viel. Immerhin wusste man, dass ein Kupfer-Atom die doppelte Masse eines Schwefel-Atoms hat.
Beispiel Schwefel und Wasserstoff
Schwefel und Wasserstoff reagieren zu dem äußerst giftigem Gas Schwefelwasserstoff. Durch aufwändige Messungen fand man heraus, dass immer eine Massen-Einheit Wasserstoff mit 16 Masseneinheiten Schwefel reagiert. Durch andere Versuche erkannte man, dass Schwefelwasserstoff die Summenformel H2S hat, also eine ähnliche Summenformel wie Wasser H2O, nur dass das Sauerstoff-Atom durch ein Schwefel-Atom ersetzt ist.
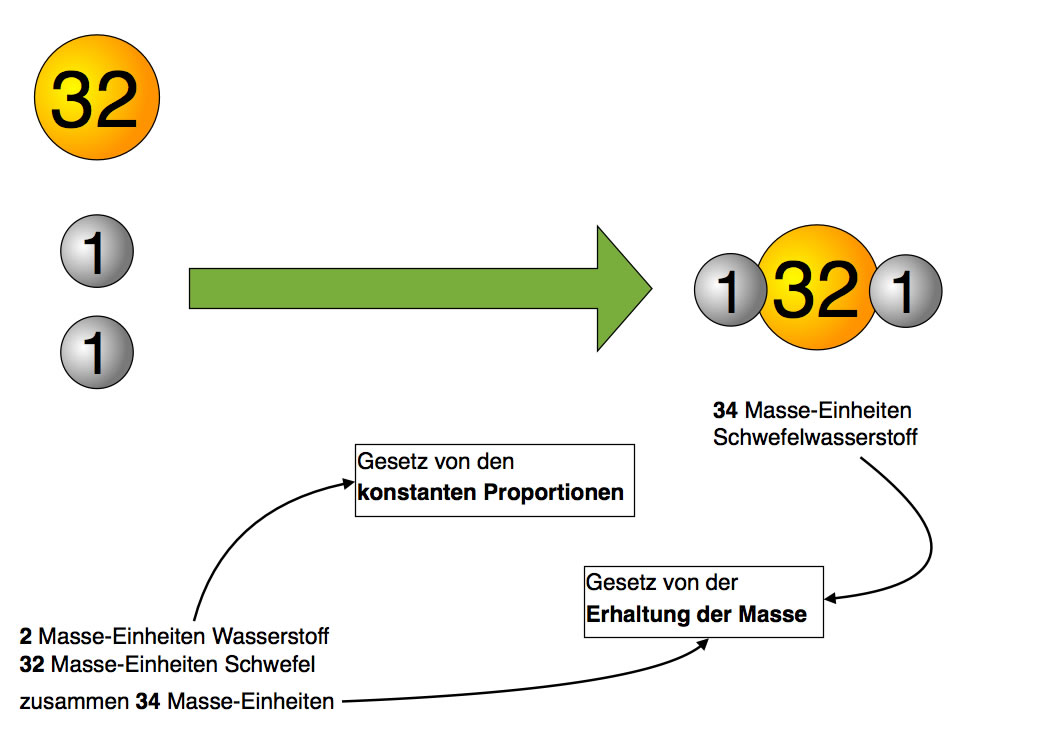
Da man wusste, dass Wasserstoff das leichteste aller Elemente ist, gab man seinen Atomen die Masse-Einheit 1. Man kann auch schreiben: M(H) = 1 u, dabei steht der Buchstabe "u" für "unit", das englische Wort für "Einheit".
Atommassen (einfache Version)
Auf dieser Seite wird eine sehr einfache Einführung in den Begriff der Atommasse geboten, für Schüler(innen) der Klasse 8 oder 9. Wenn du mehr über Atommassen wissen möchtest und vor allem die Frage klären willst, warum alle Atommassen durch eine "krumme" Zahl dargestellt werden, gehe bitte auf diese Lexikonseite. Du sollteste dann allerdings wissen, was man unter einem Isotop versteht und vielleicht auch schon mal von Einsteins Entdeckung gehört haben, dass Masse und Energie ineinander umgewandelt werden können.
Wenn ein Schwefel-Atom 32 mal so viel wiegt wie ein Wasserstoff-Atom, dann hat ein Schwefel-Atom logischerweise eine Atommasse von 32 u.
Wenn nun ein Kupfer-Atom wiederum doppelt so schwer ist wie ein Schwefel-Atom, so muss Kupfer eine Atommasse von 64 u haben.
Durch andere aufwändige Versuche konnte man die Atommassen vieler Elemente ermitteln. Als feste Bezugsgröße für diese Atommassen wählte man das Wasserstoff-Atom, dem man willkürlich die Masse 1 u zuwies.
Anmerkung für Fortgeschrittene
Die Referenz für Atommassen ist heute nicht mehr das Element Wasserstoff, sondern das Element Kohlenstoff. Die Einheit der Atommasse, 1u, ist der zwölfte Teil eines Kohlenstoff-Atoms mit 6 Neutronen und 6 Protonen. Wenn du mehr darüber lesen willst, gehe bitte zu meiner Lexikon-Seite "Atommasse".
Die LOSCHMIDT-Zahl
L = 6,022 * 1023

Kommen wir noch einmal auf die drei Stoffe Wasser, Schwefel und Kupfer zurück. In jeder Stoffportion befinden sich gleich viele Teilchen (Moleküle beim Wasser, Atome beim Schwefel und Kupfer). Die drei Massen m(H2O) = 18g, m(S) = 32g und m(Cu) = 64g entsprechen genau den Molekül- bzw. Atommassen M(H2O) = 18u, M(S) = 18u und M(Cu) = 64u.
Wiegt man eine Stoffportion einer Verbindung oder eines Elementes ab, die genau der Molekül- bzw. Atommasse entspricht, so hat man immer die gleiche Anzahl von Teilchen in dieser Stoffportion, nämlich 6,022 * 1023. Diese Zahl ist auch als LOSCHMIDT-Zahl bekannt geworden.
Der Mol-Begriff
Eine Stoffportion, die genau L Teilchen enthält, wird auch als 1 Mol bezeichnet.
Einen entsprechenden Begriff kennen wir aus dem Alltag: Eine Menge, die aus genau 12 Objekten besteht, wird als 1 Dutzend bezeichnet.
12 Eier sind also 1 Dutzend Eier, 12 Kühne sind 1 Dutzend Kühe. Entsprechend sind 6,022 * 1023 Schwefel-Atome 1 mol Schwefel, und 6,022 * 1023 Kupfer-Atome sind 1 mol Kupfer-Atome.
Wenn 2 Kupfer-Atome stets mit 1 Schwefel-Atom zu 1 Kupfersulfid-Einheit reagieren, so reagieren auch 2 Dutzend Kupfer-Atome mit 1 Dutzend Schwefel-Atomen zu 1 Dutzend Kupfersulfid-Einheiten. Und wenn man richtig viele Teilchen berücksichtigen will, kann man sagen, dass immer 2 mol Kupfer-Atome mit 1 mol Schwefel-Atome zu 1 mol Kupfersulfid-Einheiten reagieren:
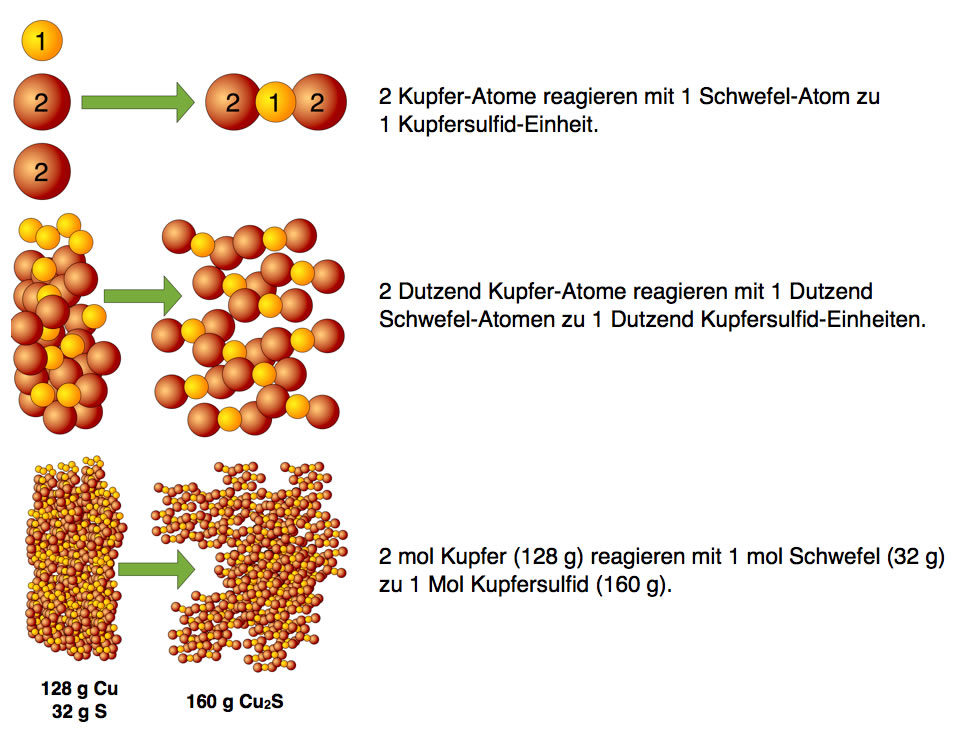
Der Chemiker macht sich die Sache allerdings einfacher und sagt, dass 2 mol Kupfer mit 1 mol Schwefel zu 1 mol Kupfersulfid reagiert.
Wenn er dann wissen will, wie viel Kupfer er auf der Waage abwiegen soll, schaut er ins Periodensystem, liest die Atommasse von Kupfer ab (64 u) und wiegt dann 64 g ab. Dann hat er genau 1 mol Kupfer. Für 2 mol Kupfer muss er dann natürlich das Doppelte abwiegen, also 128 g. Wenn er dann noch 1 mol Schwefel abwiegt, also 32 g, das Ganze mischt und anzündet, erlebt er eine heftige Reaktion, bei der sich das Kupfer und der Schwefel vollständig zu Kupfersulfid umsetzen.
Hätte er mehr als 128 g Kupfer abgewogen, also mehr als 2 mol Cu, dann würde am Ende der Reaktion Kupfer übrig bleiben. Hätte er nicht 32 g Schwefel abgewogen, sondern zum Beispiel 40 g Schwefel, so würden am Ende der Reaktion noch 8 g Schwefel übrig bleiben. Auch aus diesem Grund ist es also wichtig, den Mol-Begriff zu kennen. Man kann dann die Stoffe stets im richtigen Verhältnis abwiegen, damit die Reaktionen optimal verlaufen.
Wer mehr über den Mol-Begriff wissen willst, kann sich ja auch noch die etwas schwierigere Seite zum Thema anschauen.