Abitur NRW
Themen wie Riechsinn, Chemosensoren etc. kommen in folgenden NRW-Abituraufgaben vor:
- 2022 LK HT 1: Chemotaktile Wahrnehmung bei Octopus
- 2021 GK HT 2: Pheromoneinsatz zur Regulierung von Lobesia botrana im Weinanbau
- 2021 LK HT 1: Duftwahrnehmung bei Drosophila melanogaster
Lage des Riechsinns beim Menschen
Zunächst einmal wollen wir uns grob orientieren, wo der Riechprozess in der menschlichen Nase eigentlich stattfindet.
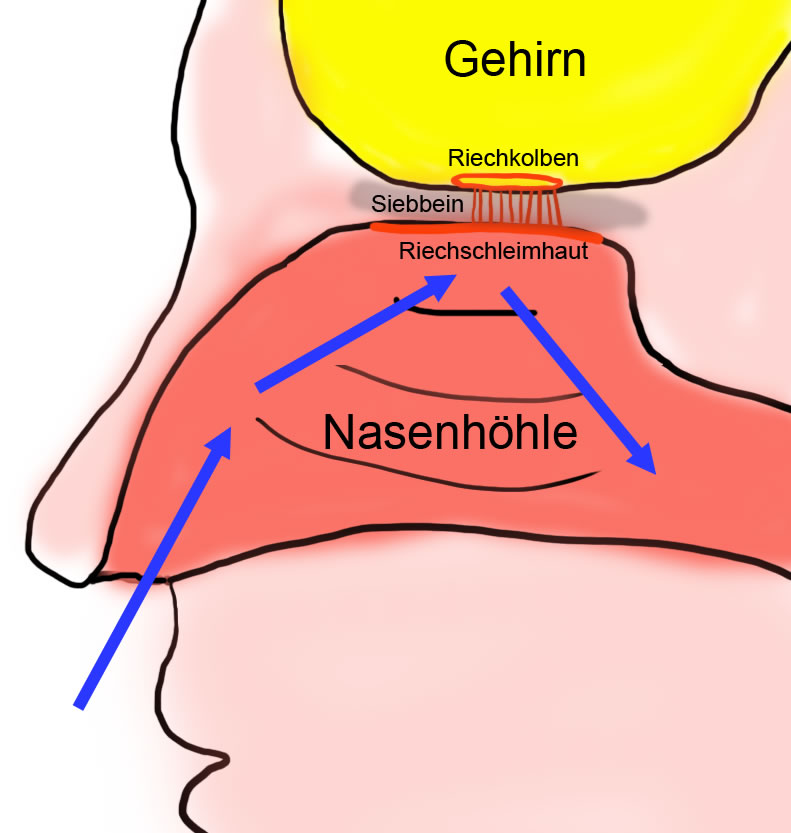
Lage des Riechsinns beim Menschen
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Auf der Abbildung sieht man die Nasenhöhle im Längsschnitt. Die Riechschleimhaut befindet sich ziemlich weit oben am Dach der Nasenhöhle. Zwischen Nasenhöhle und dem Gehirn befindet sich ein poröser Knochen, das Siebbein. Oberhalb des Siebbeins liegt der Riechkolben, eine Ausstülpung des Gehirns. Riechschleimhaut und Riechkolben sind durch viele Nervenfasern miteinander verbunden, die durch das poröse Siebbein ziehen.
Die Riechschleimhaut
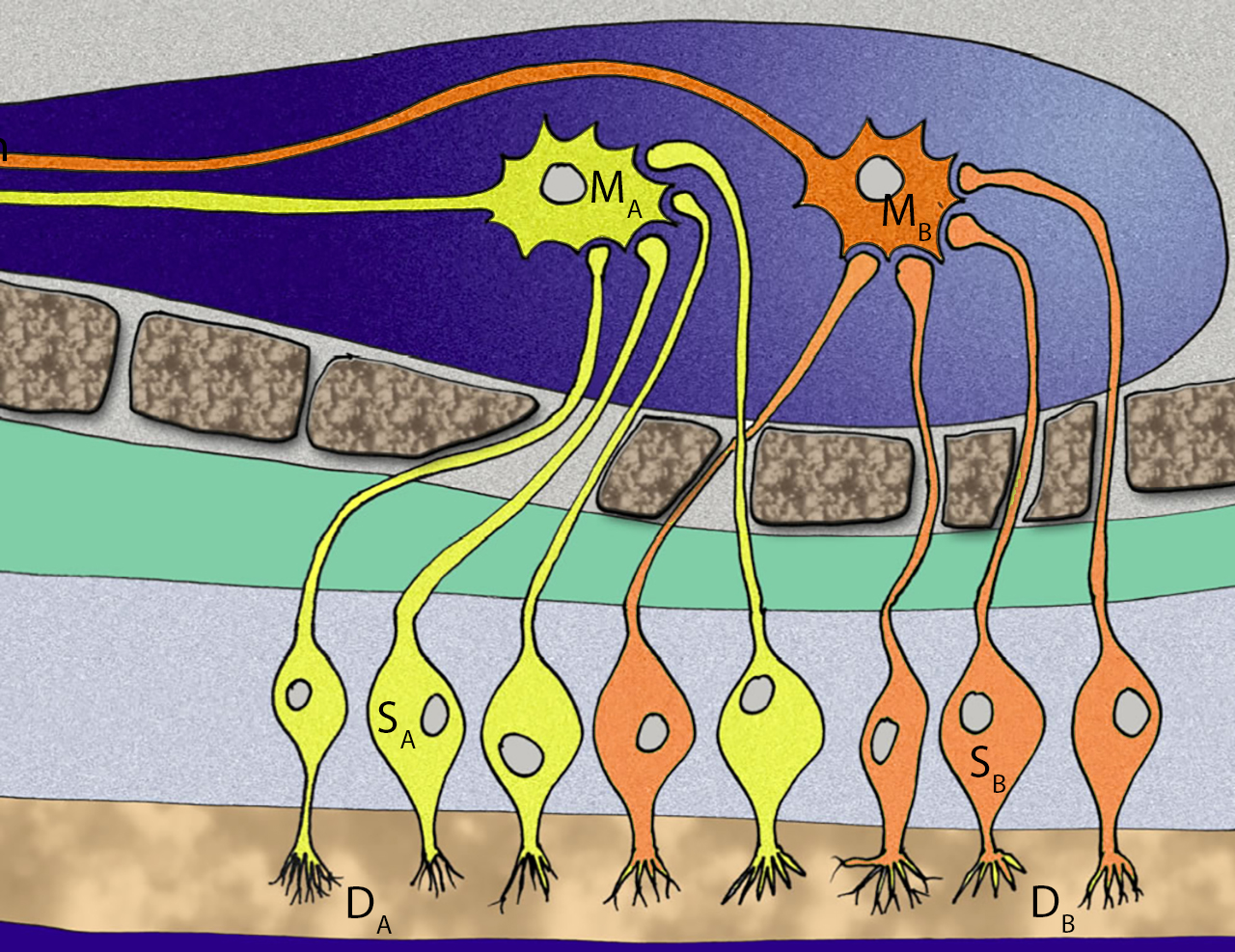
Ausschnitt aus der Riechschleimhaut mit acht Riechsinneszellen
DA DB = Duftstoffe; SA SB = Riechsinneszellen; MA MB = Mitralzellen.
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Hier sehen wir einen winzigen Ausschnitt aus der Riechschleimhaut, es sind aber nur die Riechsinneszellen eingezeichnet, auf die Stützzellen zwischen den Sinneszellen und auf die Basalzellen wurde verzichtet. Die Riechschleimhaut des Menschen ist nicht sehr groß, sie umfasst eine Fläche von ca. 2 x 5 cm2 [6, S. 340].
Insgesamt sehen wir acht Riechsinneszellen (von insgesamt ca. 30 Millionen). Die gelb markierten Sinneszellen (SA) sprechen auf den Duftstoff DA spezifisch an, die orange markierten Sinneszellen (SB) sprechen auf den Duftstoff DB spezifisch an. Insgesamt gibt es in der Riechschleimhaut des Menschen ca. 350 verschiedene Riechsinneszell-Typen, die auf entsprechend viele unterschiedliche Duftstoffe ansprechen. Rein statistisch sind das über 85.000 Riechsinneszellen für jeden der unterschiedlichen Duftstoffe.
Die für einen Duftstoff DX zuständigen Riechsinneszellen sind über ihre langen Axone mit so genannten Mitralzellen MX im Riechkolben verbunden. Die Axone verlaufen durch die kleinen Poren im Siebbein.
Ungefähr 1.000 Riechsinneszellen, die für den gleichen Duftstoff zuständig sind, senden ihre Informationen zu jeweils einer spezifischen Mitralzelle. Bei 30.000.000 Riechsinneszellen müsste es demnach also ca. 30.000 Mitralzellen geben, ca. 85 für jeden Duftstoffe (rein statistisch betrachtet, nach [6, S. 342] gibt es "nur" 20.000 Mitralzellen).
Die Abbildung 2 ist an dieser Stelle nicht ganz korrekt: Die synaptischen Endigungen der Riechsinneszellen sind meistens nicht mit dem Soma der Mitralzellen verbunden, wie in der Abbildung dargestellt, sondern mit den vielen verzweigten Dendriten, die aber nicht eingezeichnet wurden, um die Abbildung nicht zu unübersichtlich zu machen.
Hier haben wir ein Beispiel für das Prinzip der Konvergenz: Viele Sinneszellen projizieren ihre Informationen auf wenige Interneurone. Die Interneurone können so die Informationen von mehreren Sinneszellen gleichzeitig auswerten und verrechnen. Das Ergebnis senden sie dann weiter zu bestimmten Gehirnzentren.
Die Riechsinneszellen
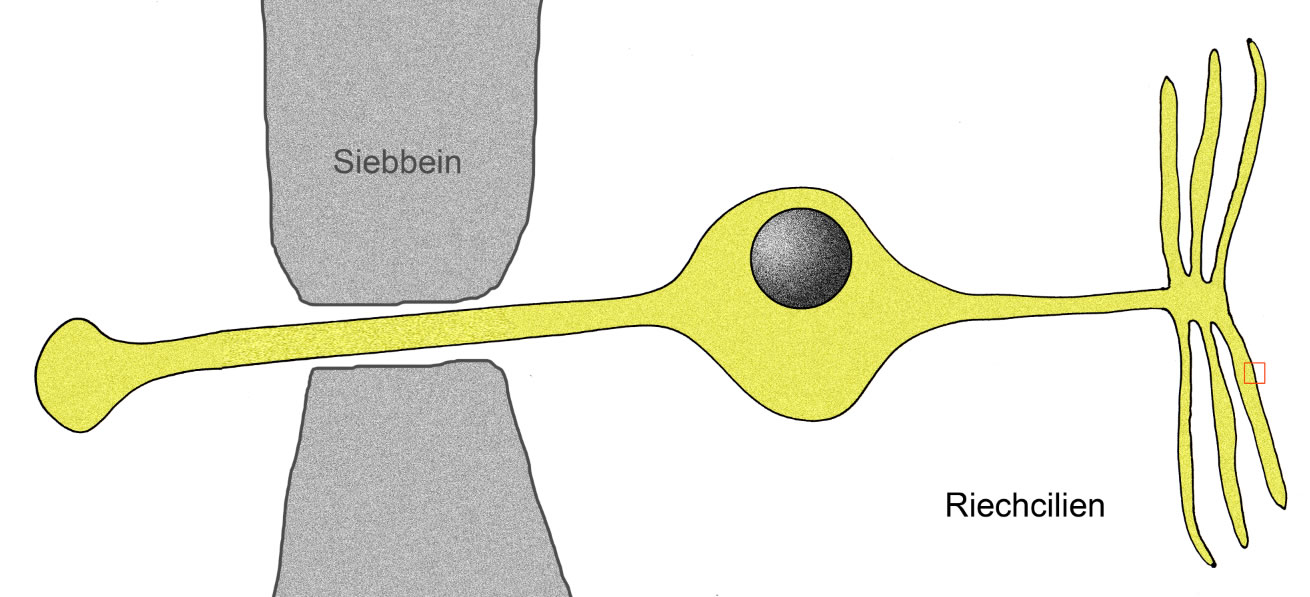
Eine Riechsinneszelle mit Riechcilien
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Hier sehen wir eine Riechsinneszelle. Links das Axon, das durch eine Pore des Siebbeins zieht, rechts die Riechcilien, mit denen die Riechsinneszelle Duftstoffe wahrnehmen kann.
Der Transduktionsprozess
Den Transduktionsprozess habe ich Ihnen in einer Reihe von Einzelbildern aufbereitet. Schauen wir uns zunächst einmal die Ausgangssituation an.

Ausschnitt aus der Membran einer Riechcilie
Hier sehen wir einen Ausschnitt aus der Membran einer Riechcilie. In die Membran sind Rezeptorproteine eingebettet, die einen bestimmten Duftstoff nach dem Schlüssel-Schloss-Prinzip aufnehmen können. Beim Menschen hat man ca. 350 bis 380 verschiedene Rezeptorproteine für Duftstoffe gefunden [1]; ein großer Teil unserer Gene ist für die Codierung dieser Rezeptorproteine verantwortlich. Auf jedem einzelnen unserer 23 Chromosomen finden sich mehrere Gene für Rezeptorproteine. Der Riechsinn ist einer der ältesten und wichtigsten Sinne der Säugetiere, der Reptilien, der Amphibien und der Fische.
Das Rezeptorprotein ist auf der Innenseite der Zellmembran mit einem G-Protein gekoppelt, das nach seiner Aktivierung seinerseits eine Adenylatcyclase aktivieren kann.
Eine Synapse, die auf ähnliche Weise funktioniert, hatten wir im diesem Kapitel der Neurobiologie kennen gelernt.
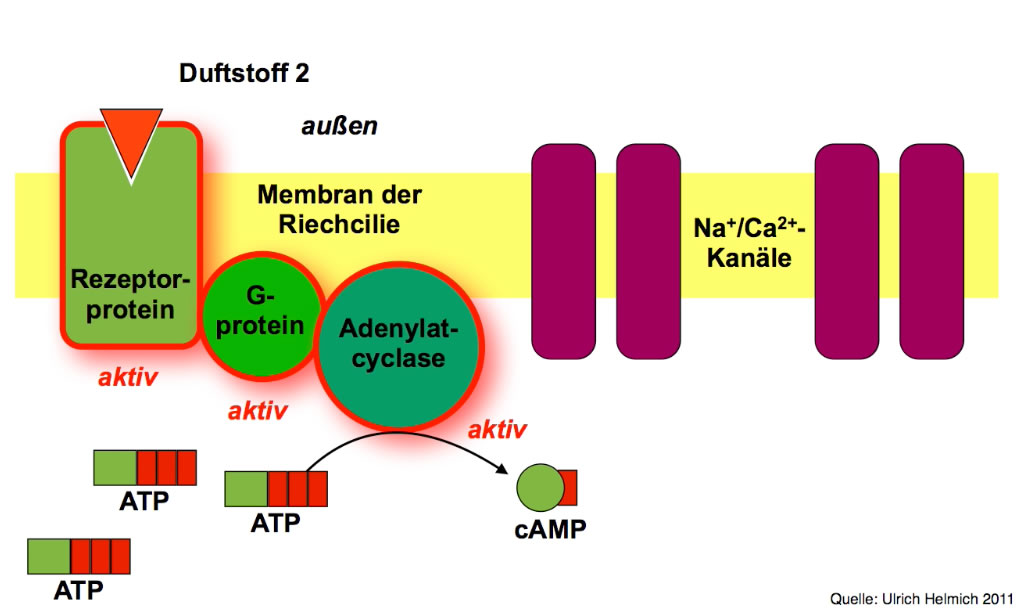
Der Duftstoff setzt die Bildung von cAMP in Gang
Das durch den Duftstoff aktivierte Rezeptorprotein aktiviert ein G-Protein, und dieses wiederum aktiviert eine Adenylatcyclase, welche Tausende von cAMP-Molekülen aus ATP herstellt. Wir haben es also mit einer Reaktionskaskade zu tun: Ein einziges Duftstoff-Molekül kann die Synthese Tausender cAMP-Moleküle bewirken. Ein typischer molekularer Verstärkungsprozess, der es uns erlaubt, geringste Mengen bestimmter Duftstoffe wahrzunehmen.
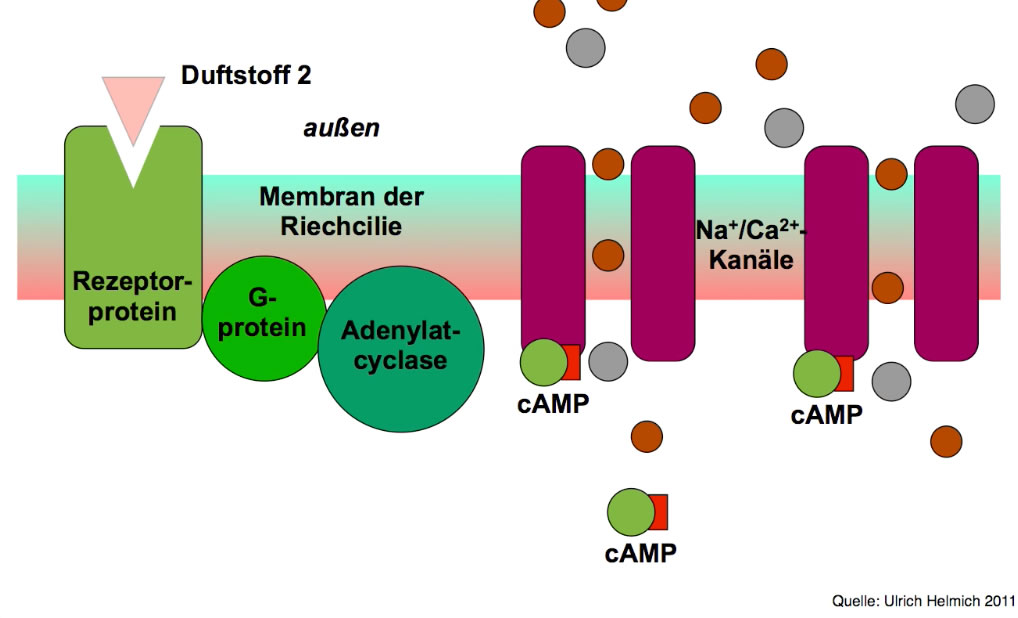
Der sekundäre Botenstoff cAMP öffnet ligandengesteuerte Natrium-Kanäle
Das letzte Bild dieser Serie zeigt nun, wie sich die cAMP-Moleküle auf der Innenseite der Membran an Na+/Ca2+-Kanäle setzen. Diese öffnen sich, und Na+-Ionen sowie Ca2+-Ionen strömen mit dem Konzentrations- und Ladungsgradienten in die Zelle. Dieser Kationen-Einstrom bewirkt dann die Depolarisierung der Membran der Riechcilie. Es entsteht ein Rezeptorpotenzial, das sich über die gesamte Nervenzelle ausbreitet und dabei räumlich und zeitlich abschwächt.
Sollte das Rezeptorpotenzial am Soma der Riechsinneszelle einen bestimmten Schwellenwert überschreiten, so bilden sich am Axonhügel der Riechsinneszelle Aktionspotenziale, und zwar um so mehr, je stärker dieser Schwellenwert überschritten wird.
Am synaptischen Endknöpfen der Riechsinneszelle werden dann Neurotransmitter freigesetzt, welche an der nachgeschalteten Mitralzelle ein Rezeptorpotenzial bewirken.
Rolle der Calcium- und Chlorid-Ionen
Die eingeströmten Ca2+-Ionen haben noch weitere Aufgaben.
Erstens setzen sie sich von innen an die Na+/Ca2+-Kanäle, die durch cAMP geöffnet wurden. Die Calcium-Ionen blockieren den Kationenkanal, so dass der Einstrom weiterer Natrium- und Calcium-Ionen stark gehemmt wird.
Man könnte dieses Phänomen mit einer Endprodukthemmung vergleichen: Wenn genug Ca2+-Ionen in der Zelle sind (Endprodukt), dann wird das dafür verantwortliche Enzym (der Na+/Ca2+-Kanal) durch die Ca2+-Ionen (das Endprodukt) gehemmt.
Zweitens setzen sich die Ca2+-Ionen auf der Membraninnenseite an bestimmte Chlorid-Kanäle und öffnen diese. Da die Chlorid-Konzentration im Außenmedium (abweichend von der Regel) niedriger ist als im Innenmedium, diffundieren Chlorid-Ionen aus der Zelle heraus und vergrößern somit das Rezeptorpotenzial.
Ein ähnliches Phänomen hatten wir bereits bei der Behandlung der Haarzellen im Innenohr kennen gelernt. Dort ist die Konzentration der Kalium-Ionen im Außenmedium (abweichend von der Regel) höher als im Innenmedium, so dass beim Öffnen der Kationen-Kanäle K+-Ionen nach außen strömen und auf diese Weise zu einer unkonventionellen Depolarisierung führen.
Wie kann man die ungewöhnlich hohe Chlorid-Konzentration in der Riechsinneszelle erklären?
In der Membran von Riechsinneszellen sitzen Na+-getriebene Chlorid-Pumpen, die nichts anderes tun, als ständig jede Menge Chlorid-Ionen in die Zelle hineinzupumpen.
Die Chlorid-Pumpe wird nicht durch ATP angetrieben, sondern es handelt sich um einen Cotransporter, und zwar um den Na+/K+/2Cl--Transporter NKCC1 [3]. Während ein Natrium-Ion passiv nach innen und ein Kalium-Ion passiv nach außen diffundieren, werden gleichzeitig zwei Chlorid-Ionen gegen den Konzentrationsgradienten (also "bergauf") nach innen "mitgerissen".
Es gibt nur ganz wenige Typen von Nervenzellen, bei denen die intrazelluläre Chlorid-Konzentration höher ist als die extrazelluläre. Gefunden wurde dieses Phänomen bisher nur bei bestimmten sensorischen Nervenzellen der Spinalganglien sowie bei den Riechsinneszellen [5]. Bei diesen beiden Zelltypen kann eine Depolarisation durch Ausstrom von Chlorid-Ionen erfolgen. Dieser Ausstrom erfolgt dann durch spezielle Ca2+-aktivierte Chlorid-Kanäle [5].
Interessant ist auch, dass der Ausstrom der Chlorid-Ionen ca. 90% des Rezeptorpotenzials verursacht; damit ist die Rolle der Chlorid-Ionen viel wichtiger als in den meisten Schulbüchern und Webseiten dargestellt [5].
Adaption
Wenn man sich für eine längere Zeit in einem überfüllten Raum aufhält, gewöhnt man sich an den unangenehmen Geruch, man nimmt ihn schließlich gar nicht mehr war. Eine solche Adaption ist ein durchaus komplexer Vorgang, daher erkläre ich ihn auf einer eigenen Vertiefungsseite. Kurz zusammengefasst kann man aber sagen, dass die Calcium-Ionen sich mit einem Protein zu einem Komplex verbinden, der sich dann an die Kationen-Kanäle setzt und diese unempfindlich für cAMP macht. Außerdem aktiviert Ca2+ ein Enzym, das cAMP abbaut [4].
Die Depolarisation wird dadurch wieder abgeschwächt, und der Duftstoff löst keine Aktionspotenziale mehr aus. Die Nase hat sich an den Geruch "gewöhnt" - der Fachausdruck hierfür ist Adaptation oder kurz Adaption.
Zeitliche und räumliche Summation
Wenn nur ein Duftstoff-Molekül an einen Rezeptor andockt, muss das noch nicht zur Ausbildung von Aktionspotenzialen am Axonhügel des Duftrezeptors führen. Obwohl es bei manchen Tieren offensichtlich vorkommt, dass bereits wenige Moleküle Duftstoff zu einer Reaktion führen, wenn man beispielsweise an Schmetterlinge und die von den Weibchen abgesonderten Pheromone denkt, die von den Männchen über viele Kilometer Entfernung noch wahrgenommen werden.
An sich hat ein Duftrezeptor aber viele gleiche Rezeptorproteine in der Membran seiner Riechcilien, und wenn mehrere Duftstoff-Moleküle gleichzeitig andocken, kommt es zu einer Art räumlicher Summation, so dass der Schwellenwert am Axonhügel erreicht wird. Auch eine zeitliche Summation ist möglich, wenn also Duftstoff-Moleküle mehrmals an das gleiche Rezeptorprotein andocken.
Wenn das Rezeptorpotenzial am Axonhügel des Duftrezeptors den Schwellenwert erreicht, werden Aktionspotenziale ausgelöst, die am Axon der Riechsinneszelle entlangwandern, durch das Siebbein hindurch und schließlich zu den Synapsen im Riechkolben gelangen, wo sie über die Ausschüttung von Neurotransmittern die dortigen Mitralzellen aktivieren.
Rezeptorproteine, Nachtrag
Eine Riechsinneszelle besitzt nicht verschiedene Rezeptorproteine für verschiedene Duftstoffe, sondern alle Rezeptorproteine einer Riechsinneszelle sind gleich. Riechsinneszellen spezialisieren sich also auf einen Duftstoff.
Zwei benachbarte Riechsinneszellen haben aber normalerweise unterschiedliche Rezeptorproteine, können also unterschiedliche Duftstoffe wahrnehmen.
Insgesamt gibt es beim Menschen ca. 350 bis 380 solcher Rezeptorproteine. Kaum ein Rezeptorprotein arbeitet hundertprozentig nach dem Schlüssel-Schloss-Prinzip. Die meisten Rezeptorproteine können mehrere verschiedene Duftstoffe wahrnehmen, auf manche reagieren sie besonders empfindlich, auf andere weniger empfindlich.
Die Anzahl der Düfte, die der Mensch wahrnehmen kann, ist aber viel größer als die paar Hundert Duftstoffrezeptoren. Amerikanische Wissenschaftler haben durch aufwändige Versuche im Jahre 2014 herausgefunden, dass der Mensch wahrscheinlich mehr als eine Billion Düfte unterscheiden kann [2].
Offensichtlich werden im Riechkolben die Informationen der einzelnen Riechsinneszellen miteinander verrechnet. Wie das geschieht, habe ich auf einer speziellen Vertiefungsseite erläutert.
Quellen:
- "Tausendfache Geruchsfänger", ein Artikel von Stephan Frings auf der Seite der Universität Heidelberg von 2008.
- "Humans Can Discriminate More than 1 Trillion Olfactory Stimuli", ein Artikel aus dem amerikanischen Science-Magazin vom 21.03.2014.
- "Chlorid-basierte Signalverstärkung in Capsaicin-sensitiven Schmerzzellen", eine Dissertation von Daniel Gilbert aus dem Jahre 2006.
- "Wie wir riechen, was wir riechen", ein Artikel von Clemens Prinz zu Waldeck und Stephan Frings in Biologie in unserer Zeit 5/2005.
- "Ca2+-aktivierte Cl--Kanäle und Cl--Akkumulation in Sinneszellen der Ratte", eine Dissertation von Ilva Putzier von 2003.
- Schmidt, Schaible, Neuro- und Sinnesphysiologie, Heidelberg 2006