Einleitung
G-Proteine sind eine Klasse von Membranproteinen, die eine zentrale Rolle in vielen zellulären Signalwegen spielen. Der Name "G-Protein" leitet sich von ihrer Fähigkeit ab, Guanosintriphosphat (GTP) zu binden und zu hydrolysieren.
G-Proteine agieren als molekulare Schalter an der Innenseite von Zellmembranen. Aktiviert werden diese Schalter durch spezielle Rezeptoren auf der Außenseite der Zellmembran. Hormonrezeptoren, Rezeptoren für Duftstoffe oder auch das Rhodopsin der Netzhaut sind typische Beispiele für solche G-Protein gekoppelten Rezeptoren (GPCRs).
Über solche GPCRs und die damit verbundenen G-Proteine können viele Prozesse reguliert werden, unter anderem Stoffwechselprozesse, die Zellteilung, die Genexpression und die Reaktion auf Umweltreize.
Aufbau eines G-Proteins
Ein G-Protein besteht aus drei Untereinheiten. Die α-Einheit ist die größte Untereinheit, die beiden kleineren Untereinheiten werden als β- und γ-Untereinheit bezeichnet.
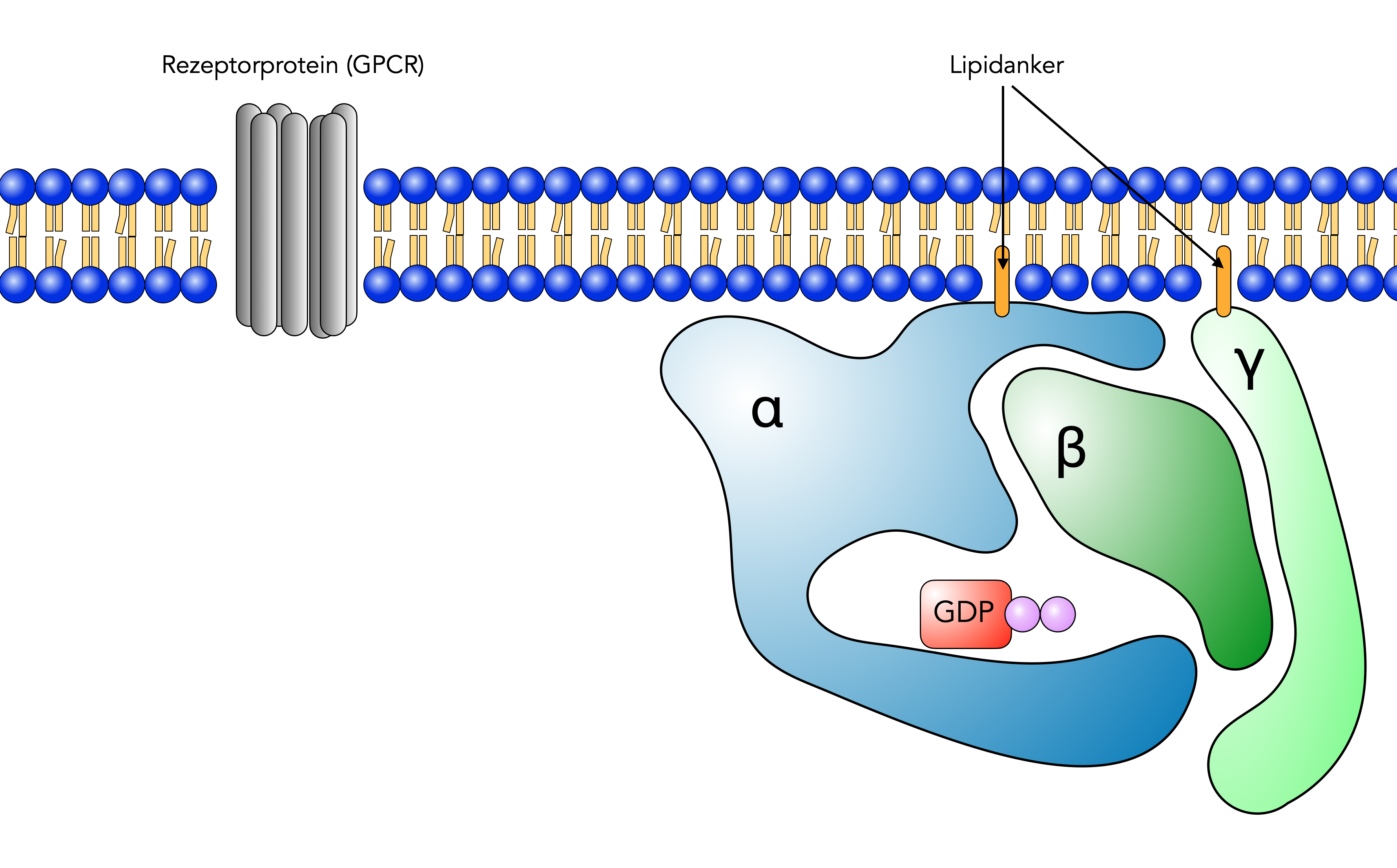
Ein G-Protein mit gebundenem GDP
Autor: Ulrich Helmich 11/2023, Lizenz: Public domain
Die α-Einheit ist über ein spezielles Lipid-Molekül (gelb gezeichnet) in der inneren Lipidschicht der Zellmembran verankert. Ein solches Lipid-Molekül, das ein Protein in der Membran verankert, wird auch als Lipid-Anker bezeichnet. Diese große Einheit besitzt außerdem eine Tasche, in der ein GTP-Molekül oder ein GDP-Molekül gebunden sein kein.
Die γ-Einheit ist ebenfalls über einen Lipid-Anker in der inneren Lipidschicht verankert, und die β-Einheit ist quasi zwischen den beiden anderen Einheiten "eingeklemmt".
Wenn das G-Protein ein GTP-Molekül gebunden hat, ist es aktiv. Befindet sich stattdessen ein GDP-Molekül in der Tasche der α-Einheit, ist das G-Protein inaktiv. In der Abbildung 1 sehen wir also ein inaktives G-Protein, außerdem ein Rezeptorprotein, das aber ebenfalls noch nicht durch ein Signal-Molekül aktiviert wurde.
Aktivierung
Schauen wir uns nun an, wie ein G-Protein durch den G-Protein gekoppelten Rezeptor aktiviert wird:
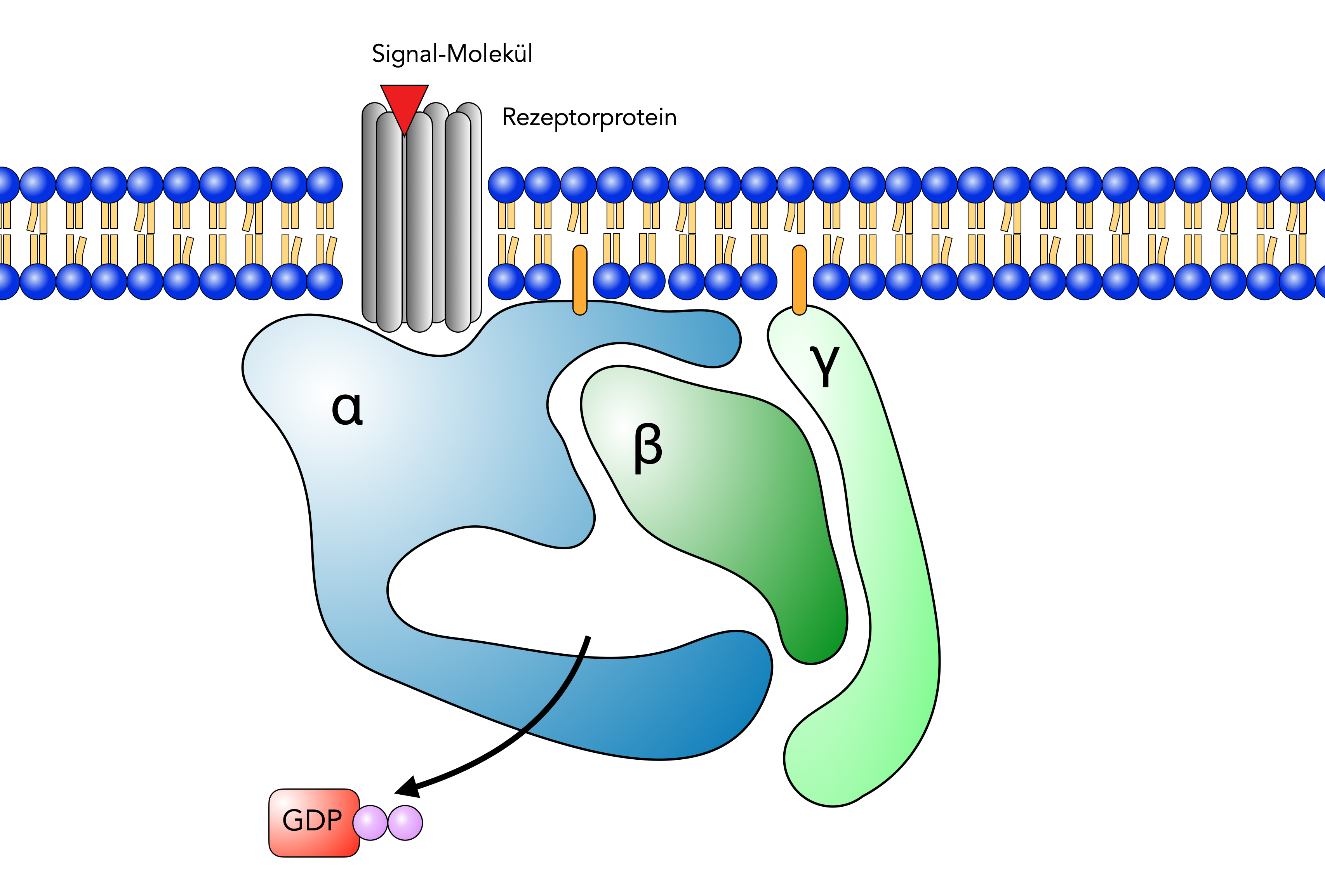
Ein G-Protein wird aktiviert
Autor: Ulrich Helmich 11/2023, Lizenz: Public domain
Manche G-Proteine sind schon vor der Aktivierung des Rezeptors mit diesem verbunden, andere G-Proteine verbinden sich erst mit dem Rezeptorprotein, nachdem dieses aktiviert wurde.
Sobald der Rezeptor durch Aufnahme eines spezifischen Signal-Moleküls aktiviert wurde (Hormon, Duftstoff etc.), verlässt das gebundene GDP-Molekül die α-Einheit des G-Proteins.
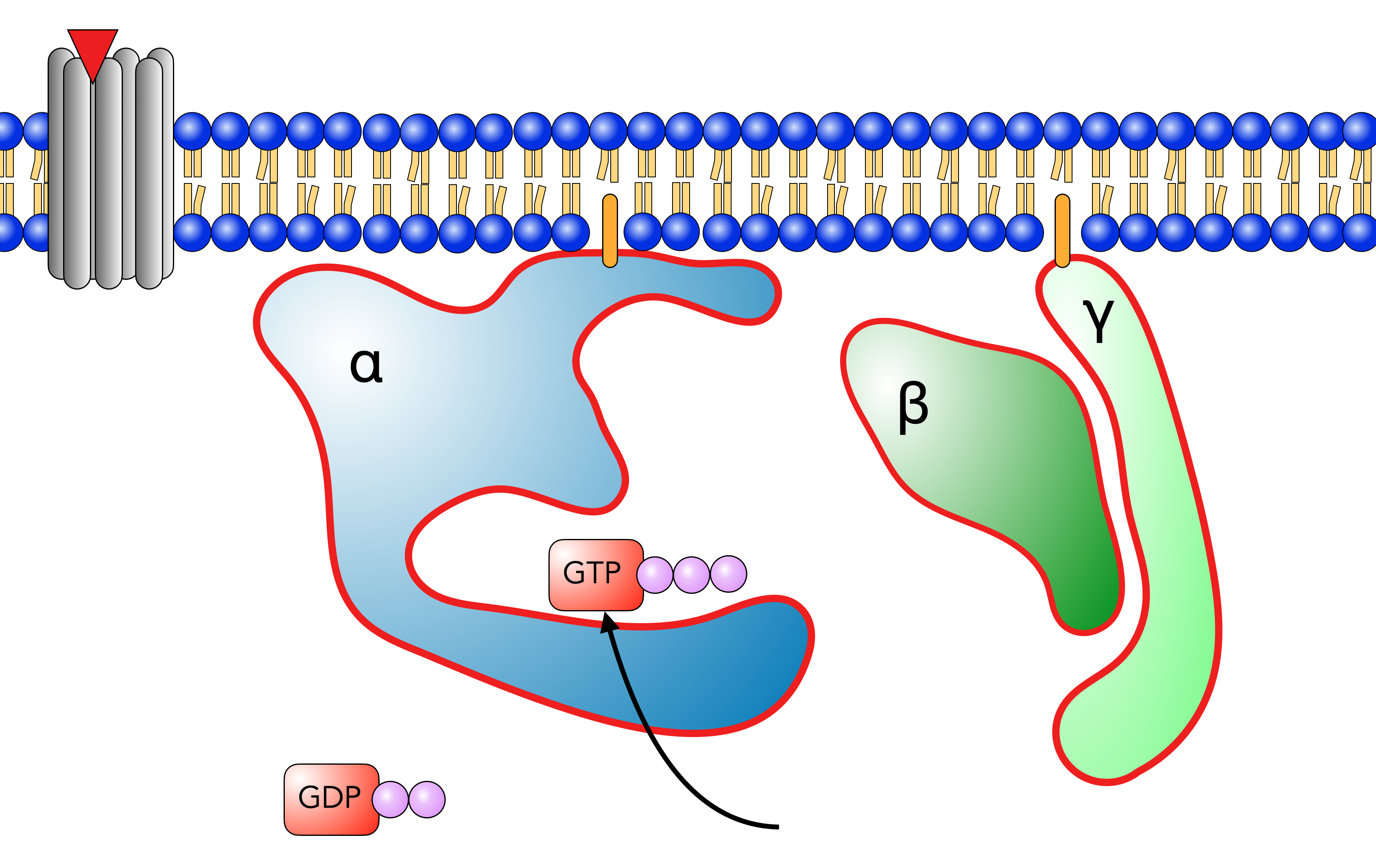
Das G-Protein nach Aktivierung
Autor: Ulrich Helmich 11/2023, Lizenz: Public domain
Die Tasche, in der sich vorher das GDP befunden hat, wird nun durch ein GTP-Molekül besetzt. Dadurch wird das G-Protein aktiviert (durch den dicken roten Rand in der Abbildung 3 gekennzeichnet). Das aktivierte G-Protein verändert seine Konformation, löst sich vom Rezeptorprotein und zerfällt in die α-Untereinheit und einen Komplex aus β- und γ-Untereinheit, oft als β/γ-Einheit bezeichnet.
Zusammenfassung der Aktivierung
In der Wikipedia wird der Aktivierungszyklus eines G-Proteins sehr schön von Sven Jähnichen (Herzlichen Dank!) zusammenfassend dargestellt:
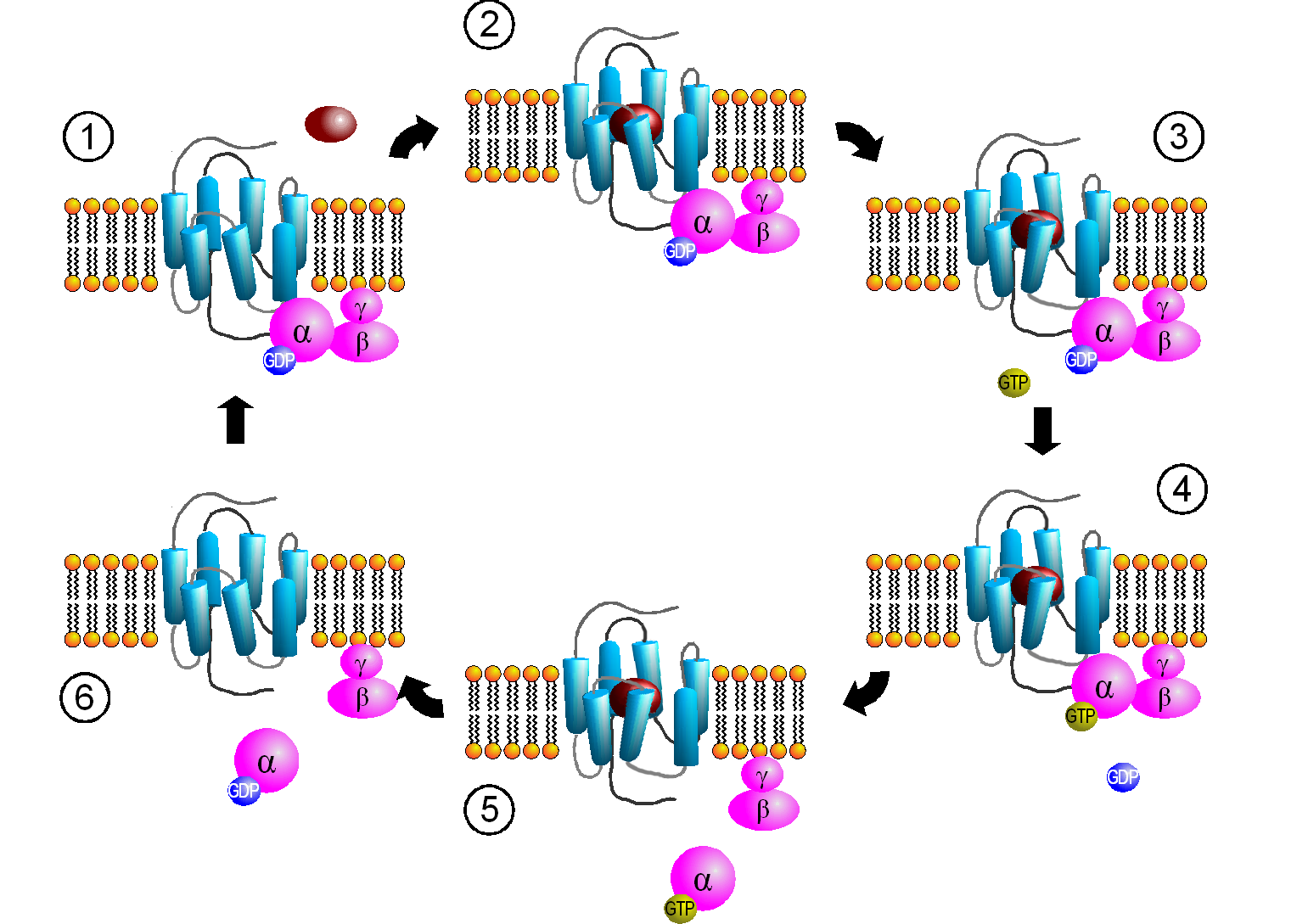
Der Aktivierungszyklus eines G-Proteins
Sven Jähnichen, CC BY-SA 3.0, via Wikimedia Commons
- Der intakte G-Protein/GDP-Komplex ist mit dem Rezeptorprotein verbunden.
- Ein Signal-Molekül setzt sich in den Rezeptor.
- Das Rezeptorprotein verändert seine Konformation.
- Das GDP-Molekül löst sich vom G-Protein und wird durch ein GTP-Molekül ersetzt. Dadurch wird das G-Protein aktiviert.
- Das aktivierte G-Protein zerfällt in den α/GTP-Komplex und den β/γ-Komplex. Beide Komplexe können nun andere Proteine aktivieren oder hemmen.
- Das GTP-Molekül des α/GTP-Komplexes verliert eine Phosphatgruppe, es bildet sich ein α/GDP-Komplex, der sich dann wieder mit einem β/γ-Komplex zusammenschließt und erneut Kontakt mit einem Rezeptorprotein aufnimmt. Der Zyklus beginnt von vorn.
Man achte darauf, dass der β/γ-Komplex weiterhin über den Lipid-Anker mit der inneren Membran verbunden bleibt, während der α/GTP-Komplex frei im Cytoplasma herum diffundieren kann.
Folgeprozesse
Sowohl die aktivierte α-Untereinheit wie auch β/γ-Einheit können nun andere Proteine aktivieren.
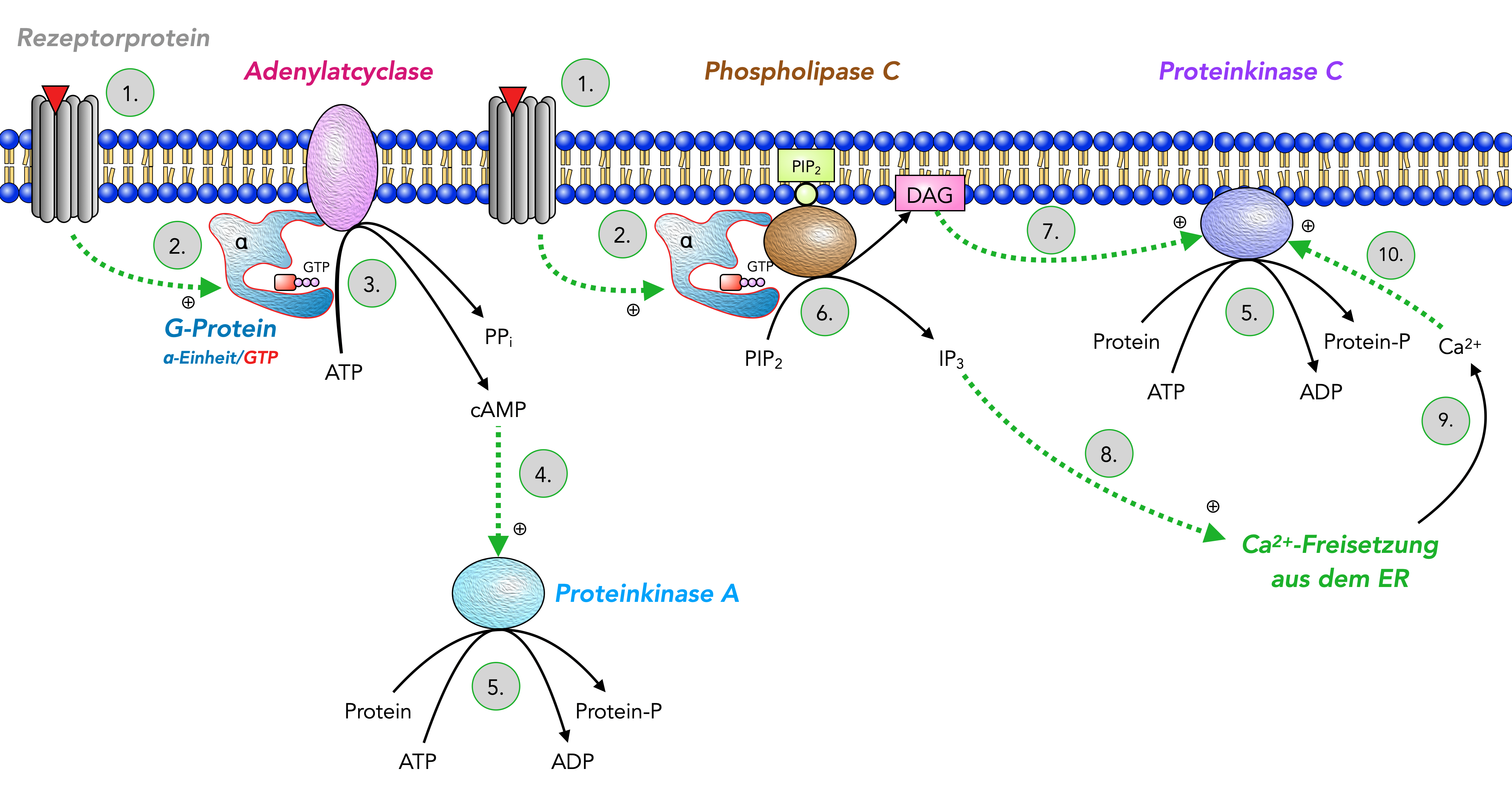
Folgeprozesse nach der Aktivierung eines trimeren G-Proteins
Autor: Ulrich Helmich 11/2023, Lizenz: Public domain
Dieses Bild zeigt die wichtigsten Folgeprozesse nach der Aktivierung eines G-Proteins.
cAMP-Weg
- Ein externes Signal-Molekül (zum Beispiel Hormon) dockt an ein Rezeptorprotein an. Auf der Membraninnenseite ändert sich dadurch die Konformation des Proteins.
- Diese Konformationsänderung wirkt sich auf ein nicht-aktive G-Protein aus, das mit dem Rezeptorprotein verbunden ist. Das GDP der α-Einheit des G-Proteins wird gegen GTP ausgetauscht, und dadurch wird das G-Protein aktiviert und zerfällt (wie oben beschrieben) in die α/GTP-Einheit und den β/γ-Komplex, der hier aber nicht zu sehen ist. Auch der GDP/GTP-Austausch wurde in der Zeichnung nicht dargestellt.
- Die aktivierte α/GTP-Einheit setzt sich in eine Adenylatcyclase, die daraufhin aktiviert wird und den second messenger cAMP aus ATP synthetisiert.
- Der second messenger cAMP diffundiert ins Cytoplasma und aktiviert dort die Proteinkinase A.
- Proteinkinase A überträgt Phosphatgruppen von ATP auf Proteine.
Der second messenger cAMP kann auch andere Prozesse einleiten, die in dem Bild nicht zu sehen sind. Beim Riechprozess beispielsweise bindet cAMP an ligandengesteuerte Natriumkanäle in der Zellmembran der Riechsinneszelle, wodurch sich diese Kanäle öffnen und Na+-Ionen passieren lassen.
Auch bei einigen Synapsen passiert Ähnliches: Der Neurotransmitter bindet an einen G-Protein gekoppelten Rezeptor, dieser aktiviert ein G-Protein, und die α-Untereinheit aktiviert wieder Adenylatcyclasen. Das produzierte cAMP setzt sich dann in Natriumkanäle, die sich daraufhin öffnen und Na+-Ionen einströmen lassen.
Neben dieser Aktivierung von Adenylatcyclase gibt es aber auch G-Proteine, deren aktivierte Untereinheiten die Adenylatcyclase hemmen, so dass die cAMP-Konzentration in der Zelle abnimmt, weil kein neues cAMP mehr gebildet wird, aber gleichzeitig ständig vorhandenes cAMP durch das Enzym Phosphodiesterase zerstört wird.
Auf dieser Lexikon-Seite erfahren Sie mehr über das Enzym Adenylatcyclase.
IP3/DAG-Weg
- Die aktivierte α/GTP-Einheit setzt sich in eine Phospholipase C. Die Phospholipase C ist ein Enzym, welches das Membranlipid Phosphatidyl-Inositol-4,5-biphosphat (PIP2) zu Inositol-1,4,5-triphosphat (IP3) und Diacylglycerin (DAG) hydrolysiert, zwei weiteren second messengern.
- DAD aktiviert eine Proteinkinase C, die eine ähnliche Funktion hat wie die Proteinkinase A (5.)
- Der second messenger IP3 setzt sich in ligandengesteuerte Ca2+-Kanäle des endoplasmatischen Reticulums und öffnet diese. Es erfolgt eine massive Ca2+-Freisetzung in das Cytoplasma.
- Die erhöhte cytoplasmatische Ca2+-Konzentration aktiviert die Proteinkinase C zusätzlich.
Auf dieser Lexikon-Seite erfahren Sie mehr über das Enzym Phospholipase C.
Kleine G-Proteine
Neben den großen, aus drei Untereinheiten zusammengesetzten G-Proteinen (die auch als trimere G-Proteine bezeichnet werden), gibt es noch eine ganze Reihe kleinerer Proteine, die ebenfalls eine G-Protein-Funktion ausüben. Diese kleinen G-Proteine bestehen nur aus einer Protein-Einheit, die homolog zur α-Untereinheit der trimeren G-Proteine ist. Inzwischen kennt man über 100 verschiedene kleine G-Proteine und teilt diese in fünf Familien ein: Ras, Rho, Rab, Sar1/Arf und Ran.
Die G-Proteine der Familien Ras und Rho spielen eine wichtige Rolle bei der Regulation der Genexpression, Rho-Proteine steuern den Zellzyklus, Rab- und Sar1/Arf-Proteine sind am Vesikeltransport in der Zelle beteiligt und so weiter.
Quellen:
- Bruce Alberts et al. Molekularbiologie der Zelle, 7. Auflage, Weinheim 2025.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.