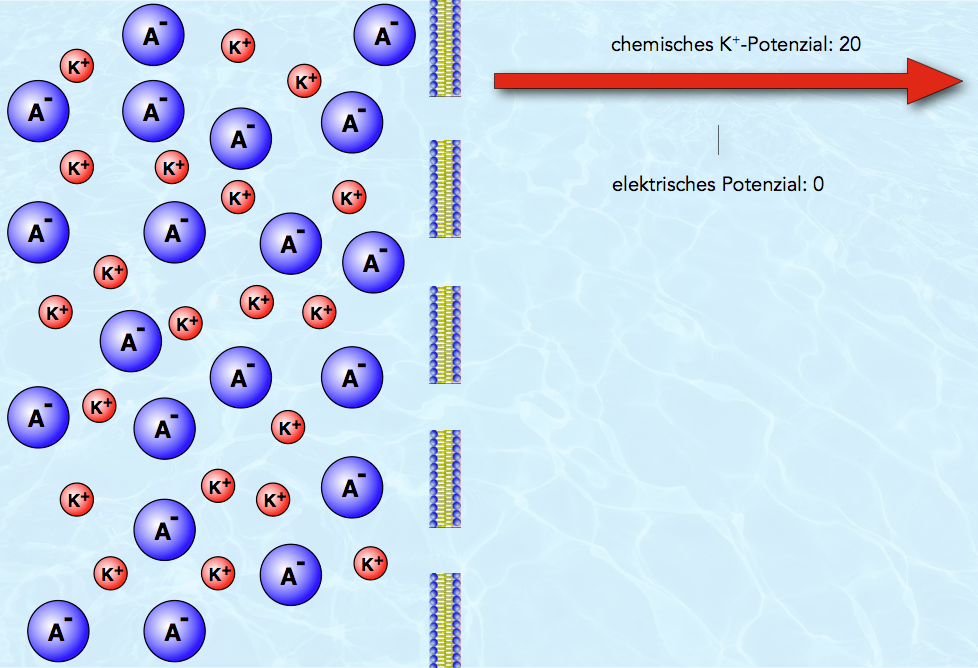
Ein Modell der Ausgangssituation
Das Bild zeigt eine modellartige Darstellung der Ausgangssituation des zweiten Modellversuchs. Die Kaliumcitrat-Lösung ist auf der linken Seite dargestellt, das dest. Wasser auf der rechten Seite. Die kleinen roten Kugeln symbolisieren die positiven Kalium-Ionen, die großen blauen Kugeln die negativen Citrat-Ionen. Man sieht sehr deutlich, dass die Kalium-Ionen durch die Poren der Membran hindurchpassen, während die großen Citrat-Ionen nicht passieren können. Die Wasser-Moleküle auf der rechten Seite (und in der Kaliumcitrat-Lösung) wurden nicht mit eingezeichnet.
Sowohl für die Kalium-Ionen wie auch für die großen Citrat-Ionen besteht ein Konzentrationsunterschied, der gleichbedeutend mit einem chemischen Potenzial ist.
Chemisches Potenzial = andere Bezeichnung für Konzentrationsunterschied. Mit dem Begriff "chemisches Potenzial" bringt man zum Ausdruck, dass dieser Konzentrationsunterschied in der Lage ist, chemische, elektrische oder andere Arbeit zu leisten. Das chemische Potenzial wird in Kilojoule gemessen, also in der Einheit der Energie.
In dem hier gezeigten Modellsystem befinden sich auf der linken Seite der Membran 20 K+-Ionen, auf der rechten Seite noch keine K+-Ionen. Das chemische K+-Potenzial hat daher den Wert 20.
Eine Spannung bzw. ein elektrisches Potenzial kann man noch nicht messen. Links haben wir 20 Kationen und 20 Anionen, also eine Gesamtladung von 0. Rechts haben wir 0 Kationen und 0 Anionen, also ebenfalls eine Gesamtladung von 0. Die Ladungsdifferenz zwischen links und rechts, das elektrische Potenzial, beträgt also ebenfalls 0.
Elektrisches Potenzial = andere Bezeichnung für Ladungsunterschied (oder Spannung). Mit dem Begriff "elektrisches Potenzial" bringt man zum Ausdruck, dass dieser Ladungsunterschied in der Lage ist, chemische, elektrische oder andere Arbeit zu leisten. Das elektrische Potenzial wird wie das chemische Potenzial in Kilojoule gemessen, also in der Einheit der Energie.
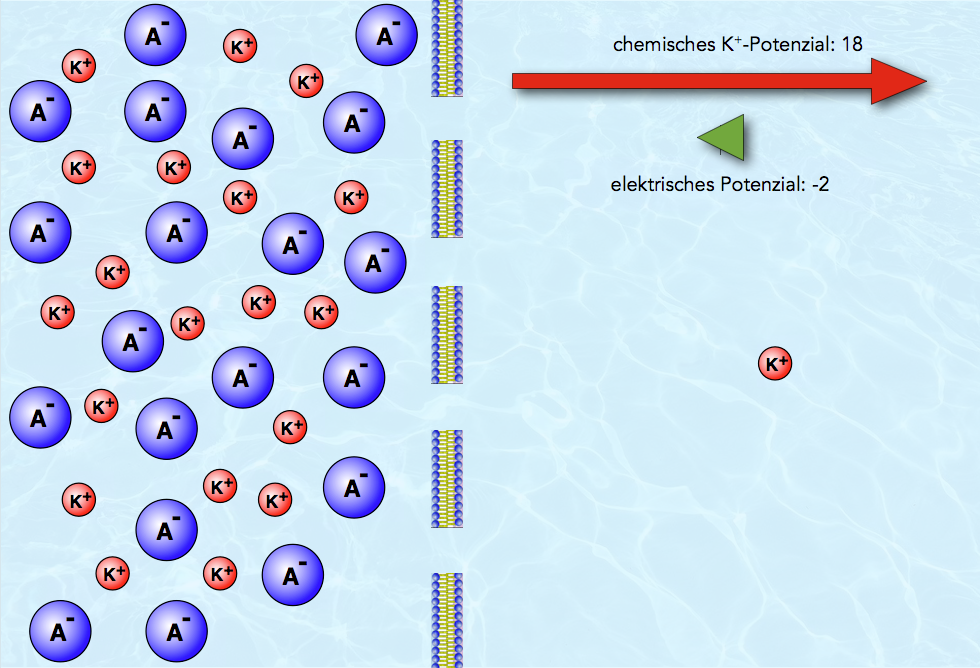
Situation nach Diffusion von einem Kalium-Ion
Ein Kalium-Ion ist - angetrieben durch das chemische K+-Potenzial - nach rechts diffundiert. Das chemische K+-Potenzial ist dadurch kleiner geworden: Links sind nur noch 19 Kationen, rechts dagegen 1, die Differenz - das K+-Potenzial - beträgt nur noch 18, ist aber immer noch relativ hoch. In der Abbildung wird dieses chemische Potenzial durch einen langen, nach rechts gerichteten roten Pfeil dargestellt.
Die Ladungsverhältnisse haben sich durch die Diffusion des positiv geladenen K+-Ions leicht geändert.
Links haben wir jetzt eine positive Ladung weniger als vorher, die Gesamtladung beträgt also -1. Rechts haben wir entsprechend eine positive Ladung mehr als zuvor, also beläuft sich die Gesamtladung rechts auf +1. Die Ladungsdifferenz - das elektrische Potenzial - hat damit den Wert -2. Das negative Vorzeichen soll darauf hinweisen, dass das elektrische Potenzial dem chemischen Potenzial entgegengerichtet ist.
Die negative Gesamtladung der linken Seite wirkt jetzt anziehend auf die Kalium-Ionen der rechten Seite.
In der Abbildung wird das elektrische Potenzial durch einen grünen, nach links gerichtete Pfeil symbolisiert, der allerdings mit einer Größe von -2 noch recht kurz ist.
Aufgabe 1
Berechnen Sie das chemische K+-Potenzial und das elektrische Potenzial für die Situation nach der Diffusion von
a)
zwei und
b)
drei
Kalium-Ionen!
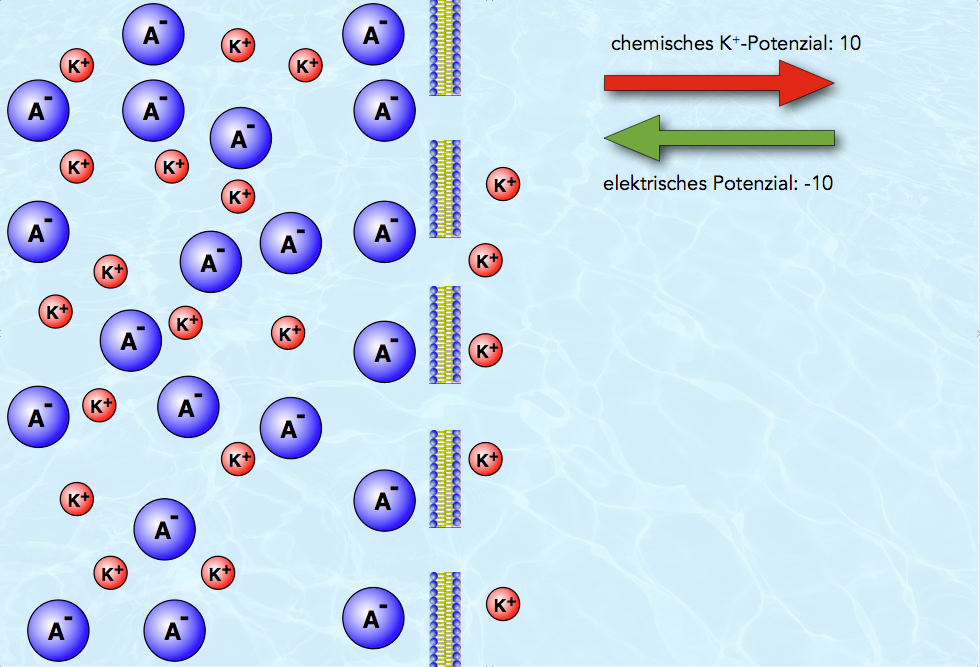
Situation nach Diffusion von fünf Kalium-Ionen
Nach der Diffusion von fünf Kalium-Ionen hat sich in unserem Modellsystem ein elektrochemisches Gleichgewicht eingestellt. Das elektrische Potenzial ist genau so groß geworden wie das chemische Potenzial. Das chemische Potenzial treibt die K+-Ionen nach rechts, das elektrische Potenzial dagegen zieht sie nach links. Dadurch heben sich die beiden Potenziale auf, es herrscht ein Gleichgewichtszustand!
Elektrochemisches Gleichgewicht: Das chemische Potenzial, welches die Kationen nach rechts treibt, hat den gleichen Wert wie das elektrische Potenzial, welches die Kationen nach links zieht. Dadurch heben sich die beiden Effekte gegenseitig auf, und es findet keine Netto-Diffusion von Kationen mehr statt.
Im Merktext steht, dass keine Netto-Diffusion von Kationen mehr stattfindet. Das bedeutet, dass ein außenstehender Betrachter nicht mehr feststellen kann, dass Kalium-Ionen von links nach rechts oder von rechts nach links diffundieren. In Wirklichkeit handelt es sich aber nicht um ein statisches Gleichgewicht, sondern um ein dynamisches. Das heißt, es findet immer noch eine "heftige" Diffusion von Kalium-Ionen statt. Aber pro Zeiteinheit diffundieren genau so viele Kationen von links nach rechts, wie von rechts nach links.
Dynamisches Gleichgewicht = ein Gleichgewicht, das dadurch zustande kommt, dass die gleiche Anzahl von Teilchen von links nach rechts diffundiert wie von rechts nach links.
Elektrochemisches Gleichgewicht
Was fällt sonst noch in der Abbildung 3 auf? Die Verteilung der Ionen hat sich geändert. Weil die Kalium-Ionen jetzt von der stark aufgeladenen linken Seite angezogen werden, schmiegen sie sich eng an die Membran an. Umgekehrt sitzen die Anionen der linken Seite ebenfalls dicht an der Membran, denn sie werden ja von der positiv aufgeladenen rechten Seite der Membran angezogen. Es hat sich also eine Art Doppelschicht links und rechts der Membran gebildet.
Aufgabe 2
- Diskutieren Sie die Frage, ob es im Zustand des elektrochemischen Gleichgewichts noch möglich ist, dass ein sechstes Kalium-Ion nach rechts diffundiert.
- Angenommen, dass das der Fall ist, berechnen Sie das chemische K+-Potenzial und das elektrische Potenzial für diesen Zustand.
- Welche Schlussfolgerungen ergeben sich aus dieser Situation?
Hier geht es zu einer Musterlösung für diese Aufgabe.