Aufgabe 2
- Diskutieren Sie die Frage, ob es im Zustand des elektrochemischen Gleichgewichts noch möglich ist, dass ein sechstes Kalium-Ion nach rechts diffundiert.
- Angenommen, dass das der Fall ist, berechnen Sie das chemische K+-Potenzial und das elektrische Potenzial für diesen Zustand.
- Welche Schlussfolgerungen ergeben sich aus dieser Situation?
Aufgabe 2.1
Das elektrochemische Gleichgewicht ist ein dynamisches Gleichgewicht. Es kommt also auch im Gleichgewichtszustand ständig zu einer Diffusion von Kalium-Ionen von links nach rechts und von rechts nach links, allerdings diffundieren pro Zeiteinheit gleich viele Ionen von links nach rechts bzw. von rechts nach links. Es ist also sehr wahrscheinlich, dass auch ein sechstes oder siebentes Kalium-Ion von links nach rechts diffundiert.
Aufgabe 2.2
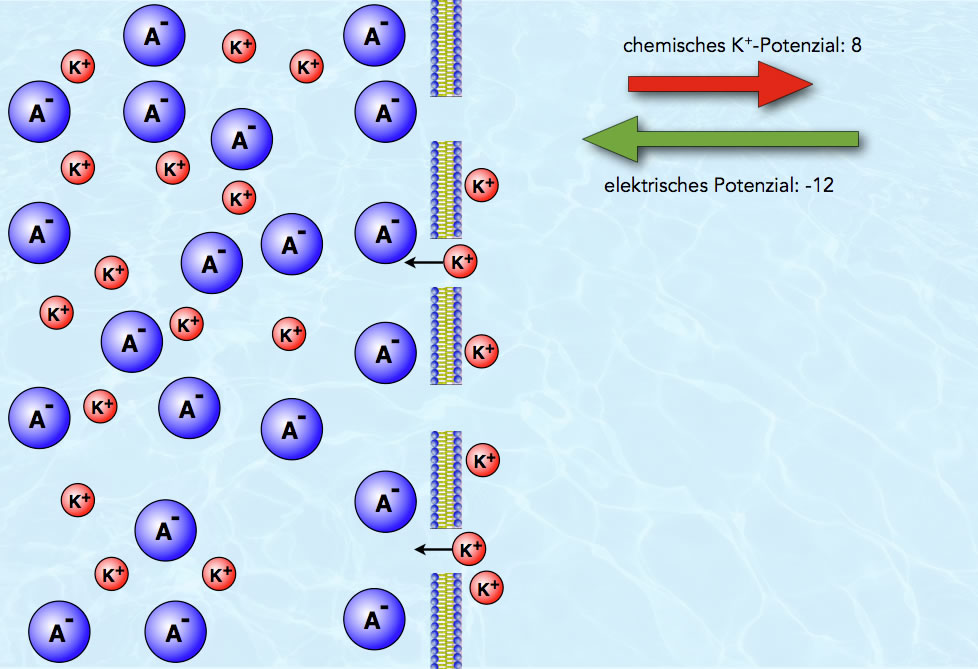
Das Bild zeigt die Situation nach der Diffusion von sechs Kalium-Ionen. Das chemische Potenzial ist weiter abgesunken, nämlich auf den Wert 8, während das elektrische Potenzial weiter gestiegen ist, nämlich auf den Wert -12.
Aufgabe 2.3
Das elektrische Potenzial, das die Kalium-Ionen nach links zieht, ist jetzt größer als das chemische Potenzial, das die Kalium-Ionen nach rechts diffundieren lässt. Obwohl noch lange kein Konzentrationsausgleich erreicht ist, diffundieren jetzt wieder mehr Kalium-Ionen von rechts nach links als von links nach rechts. In der Zeichnung ist das auch schon angedeutet: Zwei Kalium-Ionen befinden sich bereits auf dem Weg durch die Membran nach links.
Wenn diese beiden Ionen links angekommen sind, ist das chemische Potenzial mit 12 wieder größer als das elektrische mit -8. Dadurch steigt die Wahrscheinlichkeit, dass Kalium-Ionen wieder nach rechts diffundieren und sich das elektrochemische Gleichgewicht wieder einstellt.
Im elektrochemischen Gleichgewicht kommt es also ständig zu kleinen Abweichungen vom Gleichgewichtszustand, die aber durch Diffusion in die eine oder andere Richtung schnell ausgeglichen werden.