Wenn man sich eine der üblichen Zeichnungen zum Flüssig-Mosaik-Modell der Biomembranen anschaut, sieht man meistens so etwas in dieser Art:
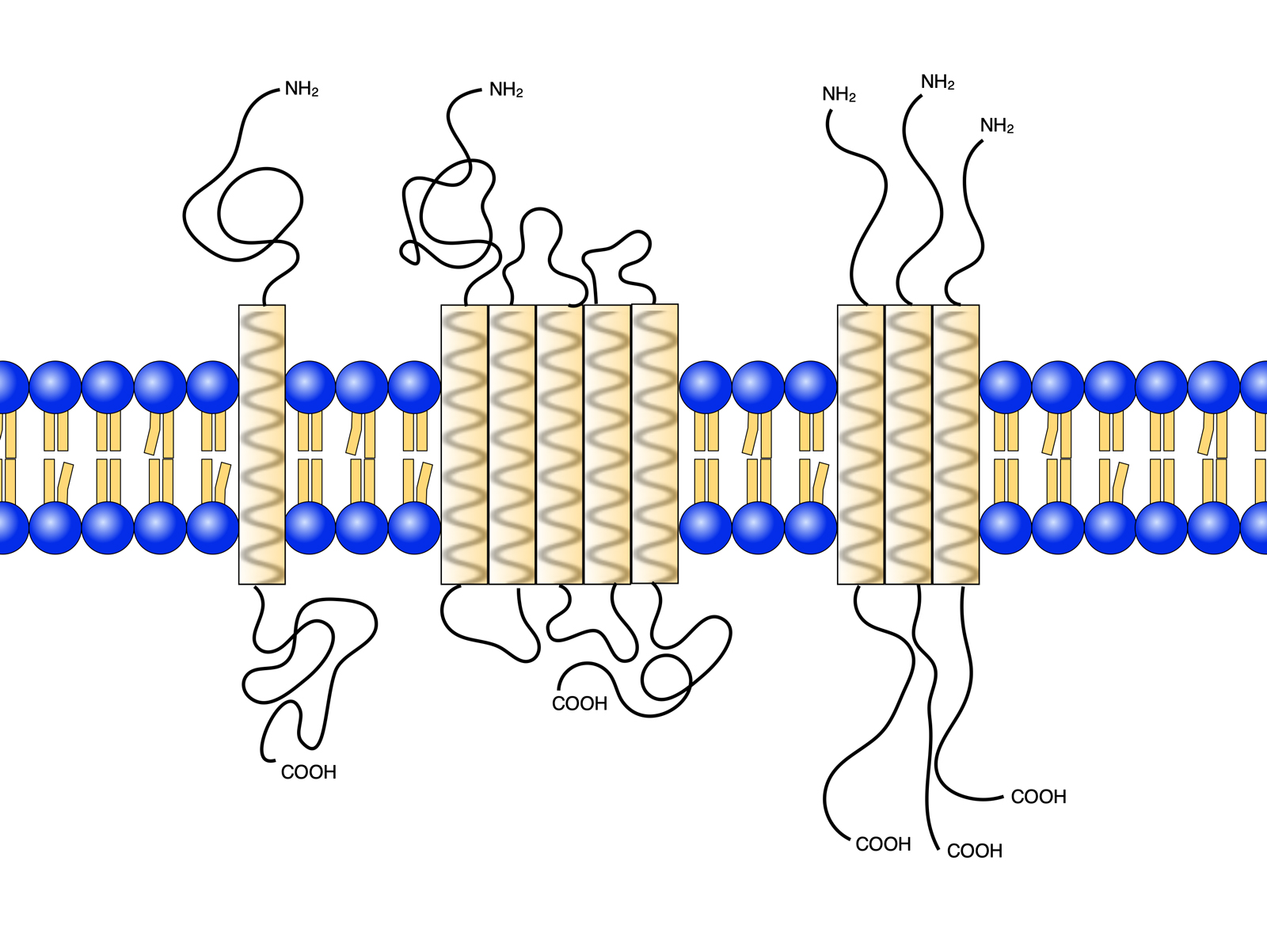
Biotope, polytope und oligomere integrale Membranproteine
Autor: Ulrich Helmich 2022, nach einem Bild aus Luckey, Lizenz: Public domain
Die verschiedenen Membranproteine liegen als periphere Proteine auf der Lipid-Doppelschicht, befinden sich als eingelagerte Proteine in einer der beiden Lipid-Schichten, oder ziehen als Transmembranproteine durch die komplette Doppelschicht.
Die Lipid-Doppelschicht wird dabei meistens so wie in der Abbildung 1 dargestellt, also sehr statisch, unbeweglich bzw. unflexibel. In Wirklichkeit passt sich die Lipid-Doppelschicht aber flexibel an die jeweils eingelagerten Proteine an, wie das folgende Bild verdeutlichen soll:
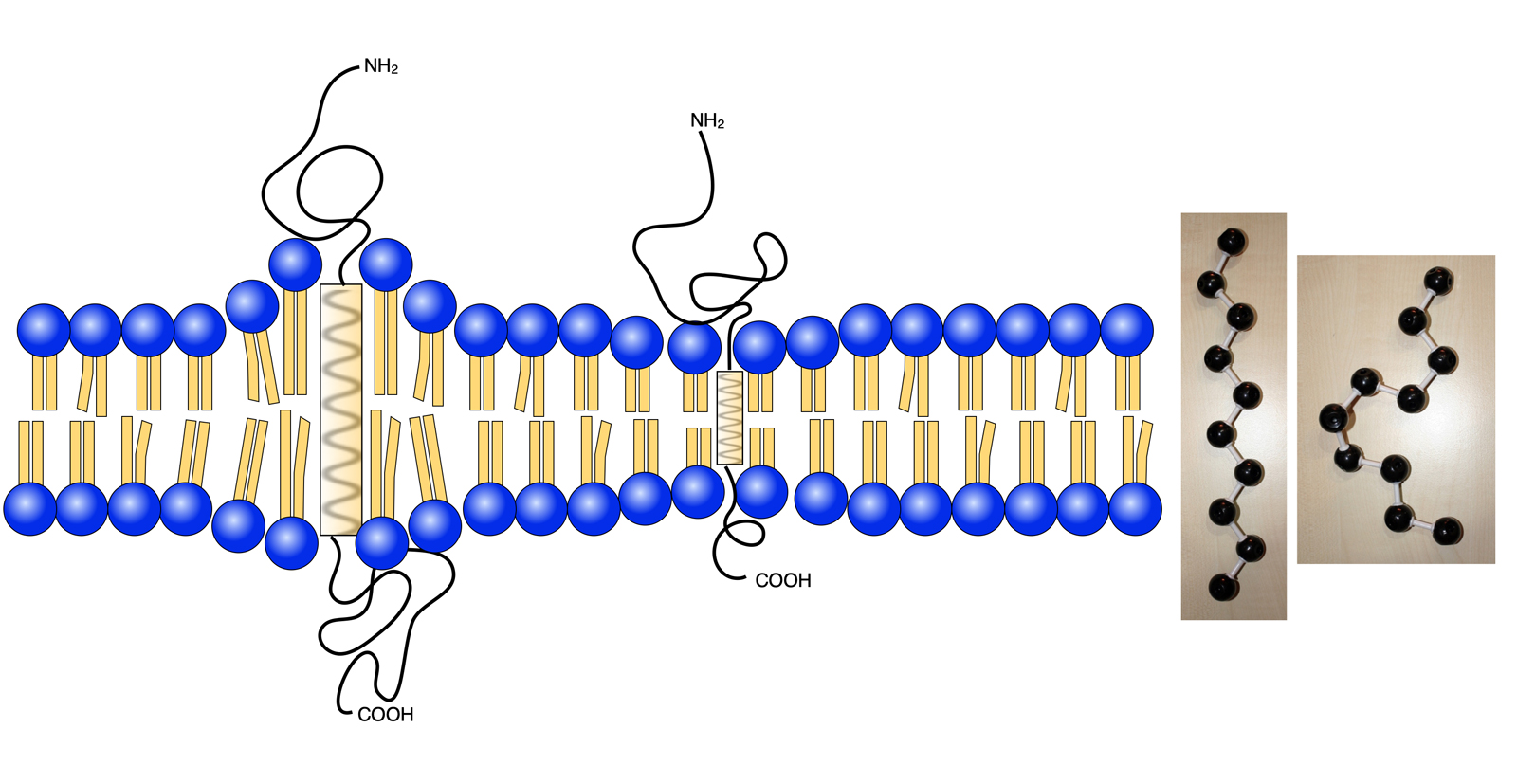
Lipide passen sich an die integrierten Proteine an
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Ist das Transmembranprotein länger, als die Lipid-Doppelschicht dick ist, dann strecken sich die Fettsäure-Reste der Lipide in die Länge. Das Umgekehrte passiert, wenn das Transmembranprotein kürzer ist als die Dicke der Doppelschicht. Ganz rechts sehen Sie Photos von zwei Molekül-Modellen einer Kette aus zehn C-Atomen (stellvertretend für die Fettsäure-Ketten in den Lipid-Molekülen). Einmal die langgestreckte Konformation, rechts daneben die viel kürzere gestauchte Konformation.
Die Lipid-Moleküle sind sehr viel flexibler als die meist sehr starren Proteine-Moleküle. Daher passen sich in der Regel die Lipid-Moleküle den eingebetteten oder Transmembranproteinen an und nicht umgekehrt. In seltenen Fällen kann aber auch das Protein seine Konformation ändern, um sich der Lipid-Doppelschicht anzupassen.
Quellen:
- Luckey, Membrane Structural Biology, 2. Auflage, Cambridge University Press 2014.
- engl. Wikipedia, Artikel "Hyrophobic mismatch".