Allgemeines
Membranen bestehen - rein zahlenmäßig - vor allem aus Lipiden, in die ein paar Proteine eingebettet sind. Laut [1] beträgt das Zahlenverhältnis Lipide - Proteine in Membranen zwischen 40 : 1 (innere Membran der Mitochondrien) und 200 : 1 (Myelinscheide der Nervenzellen). Abgesehen von einigen speziellen Lipiden auf der Cytoplasmaseite der Zellmembran (vor allem Phosphatidylinositol) haben die Membranlipide keine spezielle Funktion - außer eben die strukturelle Grundlage für die Membran zu liefern. Nach dem Fluid-mosaic-model bilden die Lipide die zweidimensionale viskose Flüssigkeit, in der die Proteine mehr oder weniger frei herumschwirren. Für die Funktion der Membran sind die Proteine zuständig - und umgekehrt benötigen viele Proteine eine Membran, damit sie richtig arbeiten können. Mehr als die Hälfte aller Proteine der Zelle ist mit einer Membran verbunden [1].
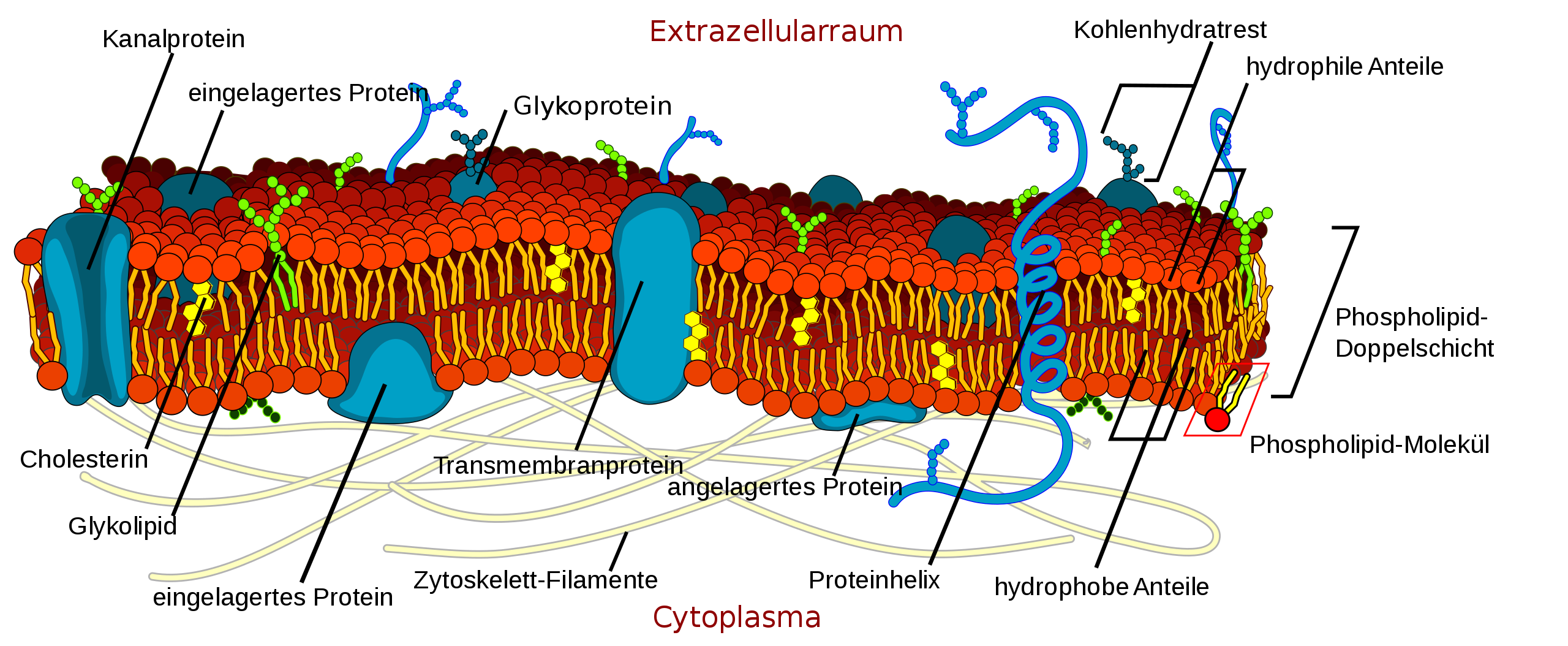
Das Flüssig-Mosaik-Modell
Quelle: Wikipedia, Artikel "Biomembran", Autor: LadyofHats, Lizenz: public domain.
Vielen Dank an die Autorin Mariana Ruiz Villarreal oder "LadyofHats", die dieses tolle Bild gezeichnet und als public domain der Allgemeinheit zur Verfügung gestellt haben.
Auf dieser schönen Abbildung erkennt man eine Lipid-Doppelschicht, in die verschiedene Proteine eingebettet sind. Grundsätzlich kann man zwischen peripheren Proteinen und integralen Proteinen unterscheiden. In der Zeichnung oben werden stattdessen die Begriffe eingelagertes Protein bzw. Transmembranprotein verwendet.
Periphere Proteine
Einfache periphere Proteine
Diese Proteine liegen der Membran locker auf. Sie sind mit der äußeren oder der inneren Lipidschicht durch schwache chemische Bindungen verbunden und können sehr leicht wieder abgespült werden, zum Beispiel durch Änderungen des pH-Wertes oder Zugabe eines Salzes. Solche locker auf der Membran liegenden Proteine werden manchmal auch als angelagerte Proteine bezeichnet.
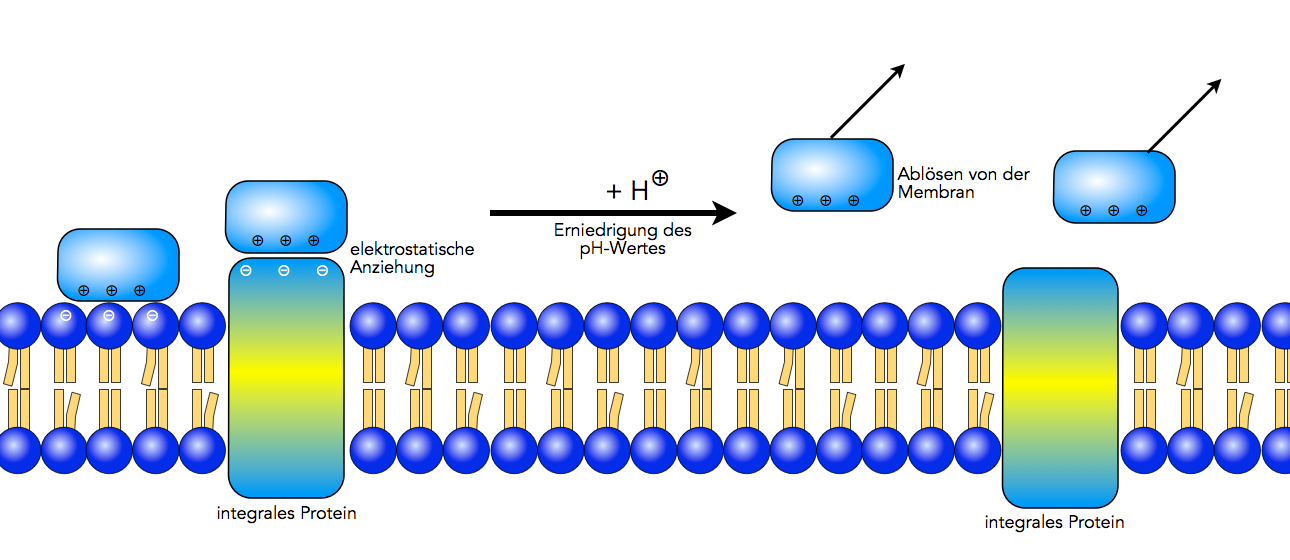
Ablösung peripherer Proteine von der Membran
Autor: Ulrich Helmich, Lizenz: Public domain
Wie die obige Abbildung zeigt, kann ein peripheres Protein durch elektrostatische Anziehungen mit einem anderen Membranprotein verbunden sein oder auch mit den Kopfregionen von Membranlipiden.
Die Abbildung 2 zeigt, wie leicht man periphere Proteine von der Membran abspalten kann. Wird das periphere Protein durch negative Ladungen angezogen, reicht oft schon eine Erniedrigung des pH-Wertes (= Zufuhr von Protonen) aus, um das Protein von der Membran zu lösen.
Amphitrope periphere Proteine
Einige periphere Membranproteine werden als amphitrope Proteine (engl.: amphitropic proteins) bezeichnet. "Normale" periphere Membranproteine sind durch schwache chemische Bindungen sehr locker und vor allem reversibel mit der Membran verbunden (siehe Abschnitt oben). Durch Änderungen des pH-Wertes oder der Konzentration bestimmter Salze lösen sich diese Proteine von der Membran und diffundieren dann frei im Zellplasma oder im Außenmedium herum. Ihre Konformation ändern diese Proteine jedoch nicht, wenn sie sich von der Membran lösen oder umgekehrt an diese andocken.
Bei den amphitropen peripheren Proteinen ist das anders. Sie sind zwar auch nur sehr locker an die Membran gebunden und gehören damit zu den peripheren Proteinen. Aber das Ablösen von der Membran bzw. das Andocken an die Membran kann erstens reguliert werden und ist zweitens mit einer Änderung der Konformation verbunden: Es gibt dann eine aktive und eine inaktive Konformation. Meistens sind diese Proteine in "gelöster" Form (also wenn sie sich frei im Cytoplasma bewegen) inaktiv. Durch bestimmte Effektoren wie zum Beispiel Ca2+ können diese Proteine jedoch dazu gebracht werden, an die Membran anzudocken und gleichzeitig in eine aktive Konformation zu wechseln.
Nach Lehninger [2] sind die amphitropen Proteine kovalent mit bestimmten Membranlipiden verbunden. Kovalente Bindungen sind ja nicht in Stein gemeißelt, sondern können durch bestimmte Enzyme leicht wieder gelöst werden. Daher können kovalent gebundene amphitrope Proteine leicht wieder von der Membran getrennt werden.
Einfache sowie amphitrope periphere Membranproteine werden auf dieser Lexikonseite ausführlich behandelt, daneben wird auch kurz auf die Lipid- und GPI-verankerten Proteine eingegangen.
Lipid-verankerte und GPI-verankerte periphere Proteine
Als Lipid-Anker bezeichnet man bestimmte Fettsäuren (Myristinsäure- oder Palmitinsäure-Reste) oder Isopren-Oligomere (Farnesyl-, Gernaylgeranyl-Reste), die kovalent an ein Protein auf der Innenseite der Membran gebunden sind (meistens über die Seitenkette der Aminosäure Cystein) und dieses Protein in der hydrophoben Mittelschicht der Zellmembran verankern.
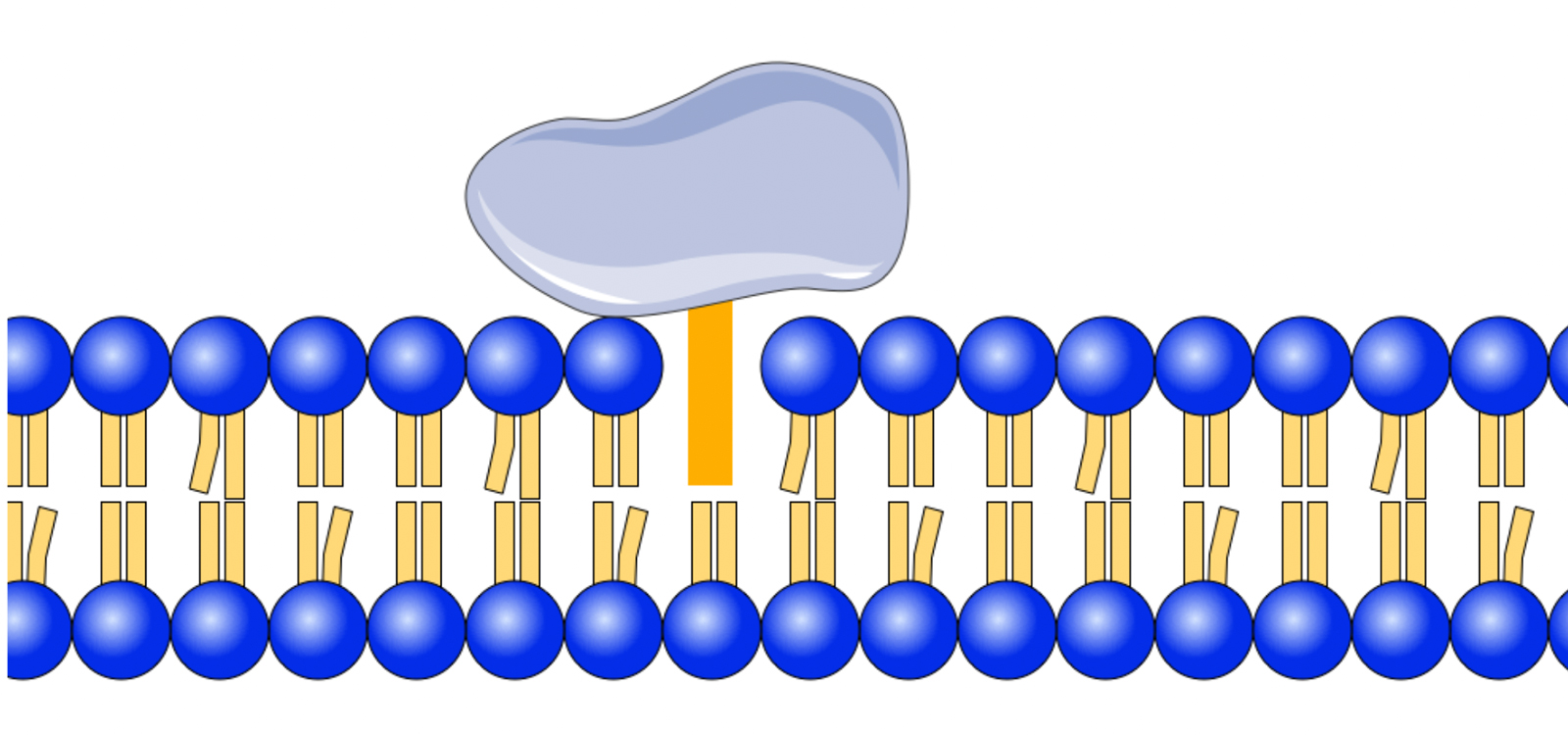
Schema eines Lipid-verankerten peripheren Membranproteins
Autor: Ulrich Helmich 2022, Lizenz: Public domain
➥GPI-Anker
Auf diesen beiden Lexikon-Seiten sind mehrere Beispiele für Lipid-verankerte Proteine aufgeführt. Auch auf die GPI-verankerten Proteine wird hier eingegangen.
Integrale Proteine
Im Gegensatz zu den angelagerten Membranproteinen, die recht locker mit der Membran verbunden sind und dieser eigentlich nur "aufliegen", sind die integralen oder eingebetteten Proteine intensiver mit der Membran verbunden oder durchziehen die Membran sogar komplett.
Monotope Proteine
Die monotopen Proteine (engl.: Monotopic proteins) sind in die innere bzw. äußere Lage der Lipid-Doppelschicht integriert. Sie liegen nicht einfach nur auf der Lipid-Doppelschicht auf, sondern ragen in eine der beiden Lagen der Lipidschicht hinein.
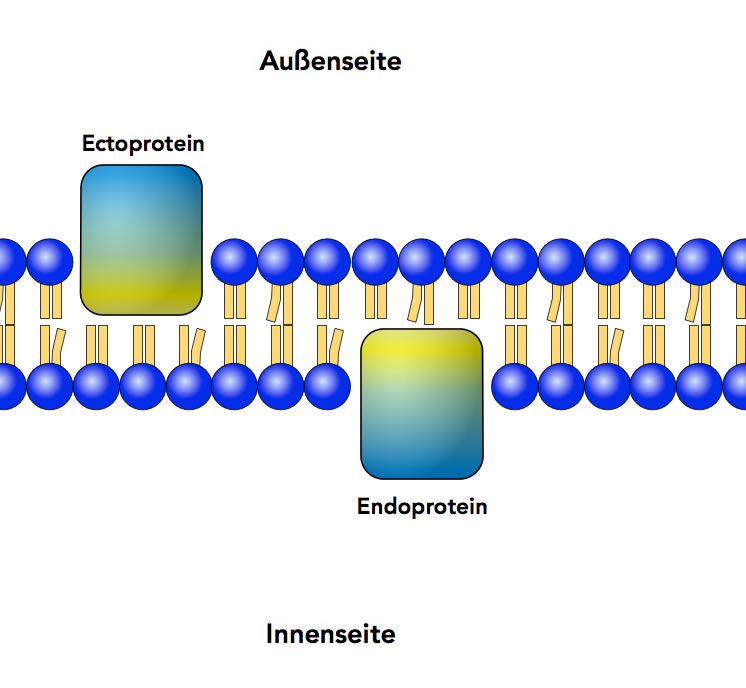
Eingelagerte Membranproteine
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Je nachdem, ob sich das Protein in die Außenseite oder in die Innenseite der Lipid-Doppelschicht eingelagert hat, unterscheidet man zwischen Endo- und Ectoproteinen. Durch schwache chemische Mittel wie pH-Wert-Änderungen oder Zufuhr von Ionen kann man diese Proteine nicht aus der Membran herauslösen, das geht nur bei manchen peripheren Proteinen. Um ein monotopen Protein aus der Membran zu lösen, sind "drastischere" Maßnahmen notwendig, zum Beispiel die Behandlung der Membran mit Detergenzien (so eine Art Spülmittel).
Auf dieser Lexikonseite erfahren Sie mehr über eingelagerte oder monotope Proteine, wie sie in der Membran verankert sind und wie sie sich von den amphitropen, Lipid- oder GPI-verankerten peripheren Proteinen unterscheiden.
Transmembranproteine
Transmembranproteine durchziehen beide Schichten der Membran. Sie bestehen aus drei Regionen. Die beiden Enden des Proteins, die zum Außenmedium bzw. zum Cytoplasma hin orientiert sind, sind hydrophil. Der Mittelteil des Proteins, der das Protein in der Lipid-Doppelschicht verankert, ist dagegen hydrophob.
Verantwortlich für den hydrophilen bzw. hydrophoben Charakter dieser Regionen des Proteins sind die Aminosäuren, aus denen das Protein besteht. In den hydrophilen Regionen überwiegen polare Aminosäuren sowie saure und basische Aminosäuren, während in den hydrophoben Regionen unpolare Aminosäuren vorherrschen.
Man kann nach ihrer Funktion grob drei Klassen von Transmembranproteinen unterscheiden:
- Kanalproteine mit einer hydrophilen Pore für polare Moleküle oder Ionen
- Carrierproteine, die unter Änderung ihrer Konformation Moleküle oder Ionen hochspezifisch transportieren, teils unter Energieaufwand sogar bergauf.
- Rezeptorproteine, die mit Signalmolekülen interagieren und diese Information an weitere Proteine oder Enzyme weiterleiten.
Man kann nach ihrer Struktur können folgende Typen von Transmembranproteinen unterschieden werden [5]:
- Bitope Proteine mit nur einer Transmembran-Helix, N-Terminus auf der Außenseite (Typ I) oder N-Terminus auf der Innenseite (Typ II)
- Polytope Proteine mit mehreren Transmembran-Segmenten in einem einzigen Polypeptid (Typ III).
- Oligomere Proteine, die aus einzelnen Polypeptiden bestehen, die mit je einer Helix durch die Membran ziehen (Typ IV).
Auf dieser Lexikon-Seite werden die Transmembranproteine ausführlich behandelt. Zunächst werden die Transmembranproteine nach ihrer Struktur eingeordnet, dann werden die drei oben genannten Funktionen näher besprochen.
Projekt: Bau eines Transmembranproteins
In meinem Biologieunterricht in der gymnasialen Oberstufe habe ich vor einigen Jahren mal ein Modell eines Ionenkanals entwickelt, der ja noch komplexer aufgebaut ist als ein einfaches Transmembranprotein, weil er im Innern noch einen durchgehenden hydrophilen Kanal besitzt. Einzelheiten zu diesem Projekt finden Sie in dem folgenden Kasten.
Kleine Aufgabe aus dem Biologie-Unterricht
Betrachten Sie folgende Aminosäurekette:

Nun bestimmen wir, welche dieser Aminosäuren polar sind und kennzeichnen durch Farben die polaren Aminosäuren (blau = basisch, rot = sauer, grün = neutral):

Wir gehen davon aus, dass sich diese Aminosäuresequenz als alpha-Helix aufspiralisiert. Dazu drucken wir die Primärstruktur farbig aus, schneiden sie aus und wickeln sie um einen dicken Stift, so dass eine Windung im Schnitt 3,6 Aminosäuren umfasst - das ist nämlich der genaue Wert für eine alpha-Helix.
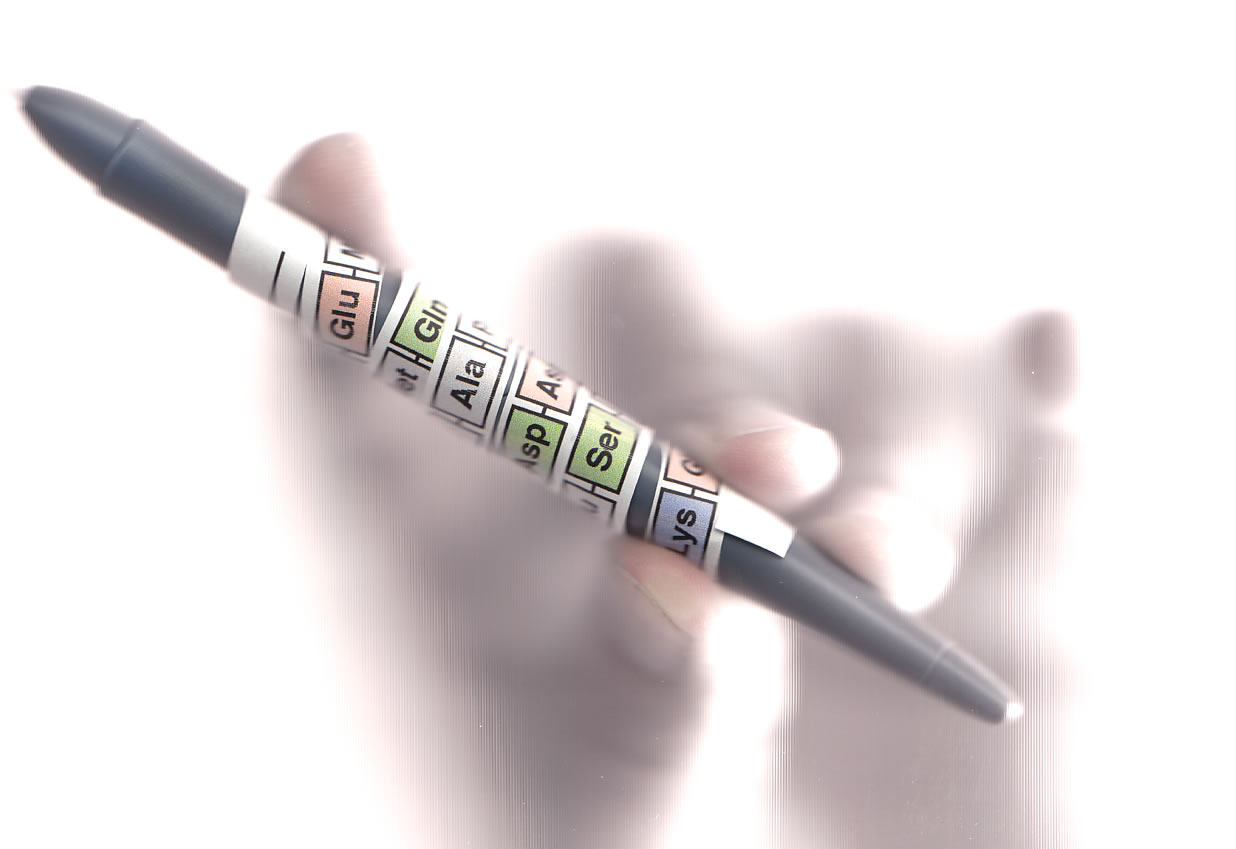
Die ausgeschnittene Aminosäuresequenz wurde um einen dicken Stift gewickelt
Autor: Ulrich Helmich, Lizenz: Public domain
Wenn wir den Streifen um einen dicken Kugelschreiber wickeln, kann man alle sieben polaren Aminosäuren auf der einen Seite der Helix erkennen.
Die alpha-Helix, die sich aus den Aminosäuren ergibt, hat also eine polare Seite und eine unpolare Seite.
Damit allein kann man noch nicht viel anfangen. Wenn aber mehrere solcher Helices zusammenkommen, ergibt sich eine interessante Struktur, die ich Ihnen auch mal zeigen möchte:
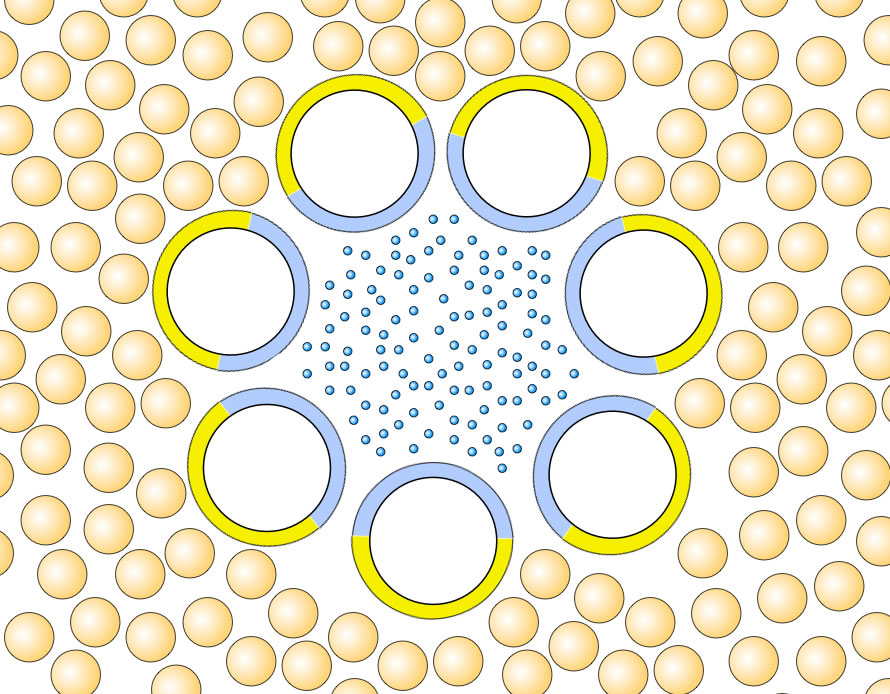
Sieben alpha-Helices bilden einen hydrophilen Kanal; Aufsicht.
Autor: Ulrich Helmich. Lizenz: Public domain.
Die Abbildung oben zeigt ein komplexeres integrales Kanalprotein in der Aufsicht. Die Kreise stellen jeweils eine Alpha-Helix dar, die die gesamte Lipid-Doppelschicht durchzieht. Blau steht für hydrophil, gelb für hydrophob. Sieben dieser Alpha-Helices ordnen sich in der Membran jetzt so zueinander an, dass sie einen hydrophilen Kanal bilden, durch den Wasser-Moleküle mit gelösten Teilchen die Membran passieren können.
Nach außen hin ist das Gebilde aus sieben Helices aber hydrophob und kann somit gut in der Lipid-Doppelschicht verankert werden.
Quellen:
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- engl. Wikipedia, Artikel "sodium channel".
- Wikipedia, Artikel "Porine".
- Luckey, Membrane Structural Biology, 2. Auflage, Cambridge University Press 2014.