Glycoproteine sind Membranproteine, die über eine bestimmte Aminosäure mit einem Oligosaccharid aus max. 15 Zucker-Einheiten kovalent verbunden sind.
Alles über Membranproteine können Sie auf dieser Seite der Zellbiologie-Abteilung nachlesen.
Glycoproteine (oft auch "Glykoproteine" geschrieben) sind recht häufig in der Zellmembran anzutreffen, laut [1] bestehen ca. 50% des Proteoms (also der Gesamtheit aller Proteine) aus Glycoproteinen.
Bindung des Zuckers an das Protein
Wie ist der Zucker - in der Regel ein Oligosaccharid aus maximal 15 Monosacchariden - an das Protein gebunden? Schauen wir uns dazu das folgende Bild an.
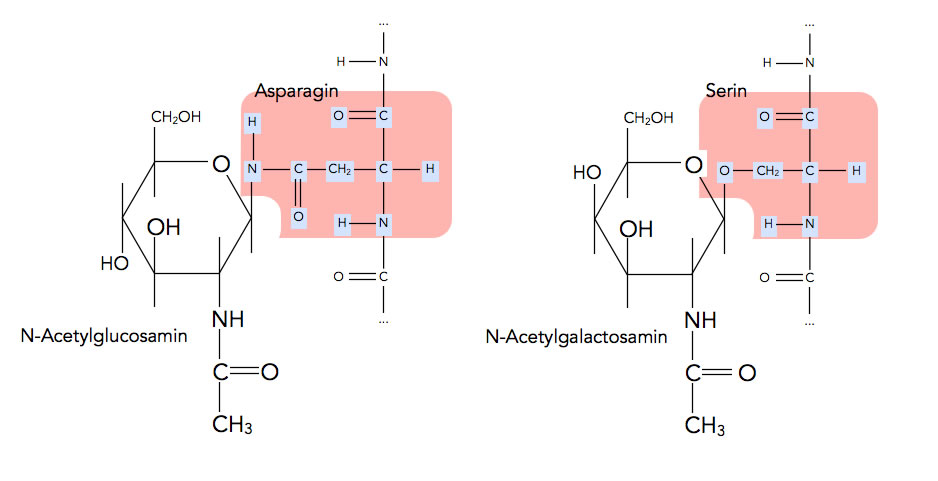
N-glycosidische und O-glycosidische Bindung zwischen einer Aminosäure und einem Zucker-Molekül
Autor: Ulrich Helmich, nach einer Zeichnung aus Stillwell [1], Lizenz: Public domain
Hier sehen wir links, wie das Glucose-Derivat N-Acetylglucosamin über das N-Atom einer Asparagin-Seitenkette an ein Protein gebunden ist: N-glycosidische Bindung.
N-Acetylglucosamin
Ersetzt man die OH-Gruppe am zweiten C-Atom eines Glucose-Moleküls durch eine NH2-Gruppe, so erhält man das Glucose-Derivat Glucosamin.
Wenn sich diese Aminogruppe dann unter Wasser-Abgabe (Kondensation) mit der Carboxygruppe eines Essigsäure-Moleküls verbindet, erhält man N-Acetylglucosamin.
Der Namensteil "Acetyl" steht für den Essigsäure-Rest, das "N" weist darauf hin, dass die Essigsäure an das N-Atom des Glucosamins gebunden ist und nicht etwa an eine der drei OH-Gruppen des Moleküls, was ja auch möglich wäre.
Rechts im Bild sehen wir das Galactose-Derivat N-Acetylgalactosamin über das O-Atom einer Serin-Seitenkette an das Proteins gebunden ist: O-glycosidische Bindung.
Neben den Aminosäuren Asparagin (N-glycosidisch) und Serin (O-glycosidisch) können auch die Aminosäuren Threonin und Hydroxylysin ein Mono- oder Oligosaccharid binden (O-glycosidisch) [3]. Das gebundene Monosaccharid kann dann mit weiteren Monosacchariden zu einem Oligosaccharid verknüpft sein, das auch verzweigt sein kann.
Einteilung der Glycoproteine
Nach [1] werden die Glycoproteine in drei Klassen eingeteilt.
Einfache Glycoproteine
Hier bildet die Proteinkomponente den Hauptteil des Moleküls, das Mono- oder Oligosaccharid ist nur ein kleines "Anhängsel". Diese Gruppe der Glycoproteine ist sehr vielseitig, und sie ist auch zusammen mit den Glycolipiden hauptsächlich am Aufbau der Glycocalyx beteiligt, der Zuckerhülle, die auf die Membran vieler Tier- und Prokaryotenzellen aufgelagert ist (Pflanzenzellen brauchen eine solche Glycocalyx nicht, weil sie ja eine dicke Zellwand haben).
Auf dieser Seite werden der Aufbau der Glycocalyx sowie ihre Funktionen ausführlich dargestellt.
Proteoglycane
Bei dieser Klasse der Glycoproteine bildet die Zuckerkette den Hauptteil des Moleküls. Glaubt man der Wikipedia (Artikel "Proteoglykane", abgerufen am 24.09.2022), dann macht der Zucker-Anteil sogar über 90% der molaren Masse eines Proteoglycans aus.
Bei den gebundenen Zucker-Einheiten handelt es sich allerdings nicht um einfache Oligosaccharide aus drei, vier oder mehr Monosaccharid-Einheiten, sondern um komplexe Glycosaminglycane (GAGs).
Glycosaminglycane
Bei dieser Stoffklasse handelt es sich im Grunde schon um Polysaccharide, allerdings um recht kurze Polysaccharide. Die Grundeinheit bzw. das Monomer eines Glycosaminglycans besteht aus einem Disaccharid. Dieses Disaccharid besteht dann meistens aus einer Glucuronsäure und einem Aminozucker wie N-Acetylglucosamin (siehe oben).
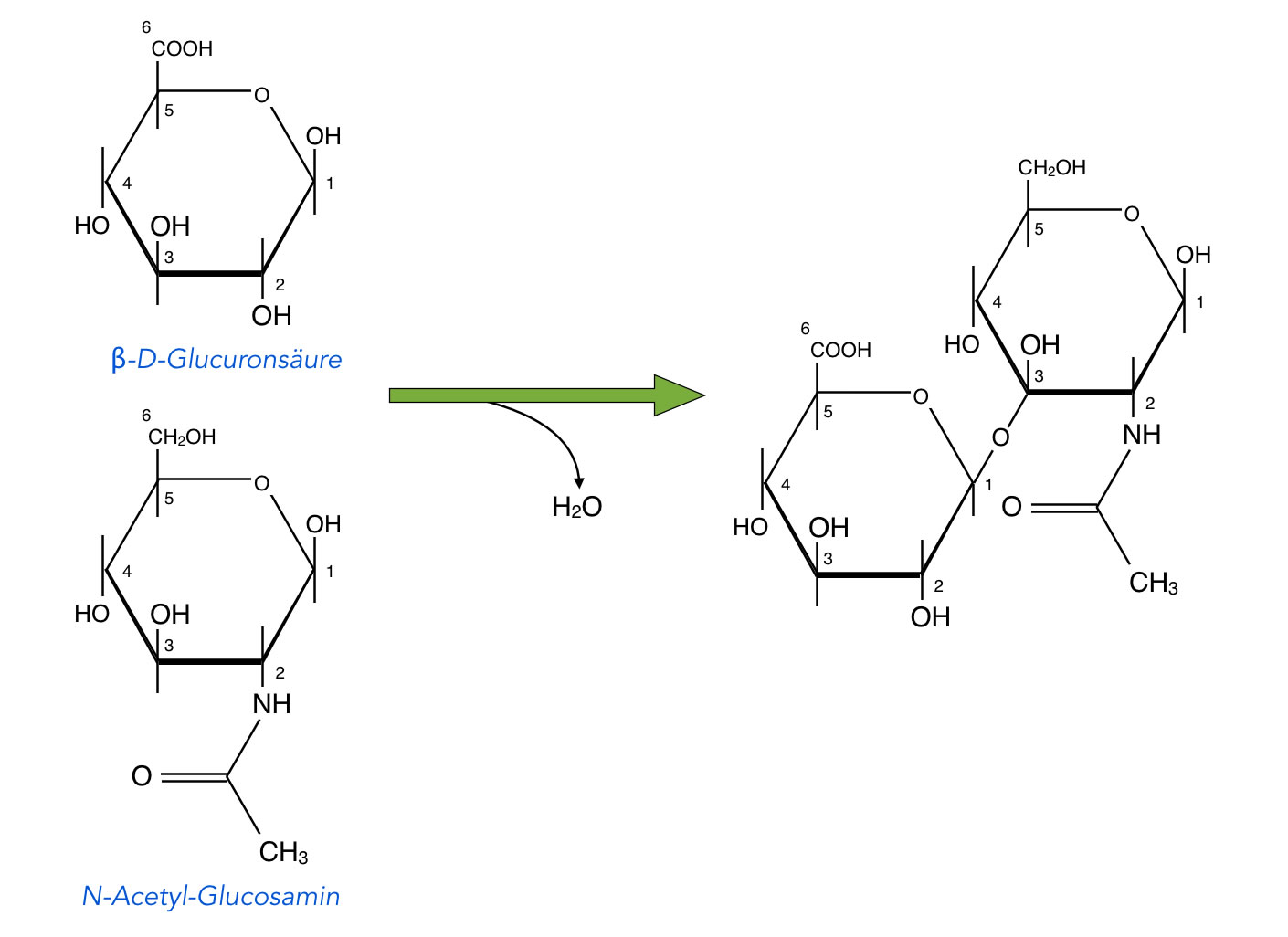
Ein möglicher Baustein eines Glycosaminglycans
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Viele solcher Bausteine sind dann zu einem Glycosaminglycan vereinigt, dem Zucker-Anteil eines Proteoglycans.
Ein bekanntes (und viel verkauftes) Glycosaminglycan ist die Hyaluronsäure, auch als "Gelenkschmiere" bekannt. Eine Gruppe anderer bekannter Vertreter dieser Stoffklasse sind die Heparine, Polysaccharide, die hemmend auf die Blutgerinnung wirken.
Proteoglycane befinden sich vor allem in der extrazellulären Matrix, der Grundsubstanz, die die Zellen tierischer Gewebe zusammenhält. Sie bilden hier netzwerkartige Verknüpfungen zu anderen Komponenten, vor allem zu Kollagen und Hyaluronsäure [4].
Mucoproteine (Mucine)
Auch diese Glycoproteine bestehen vorwiegend aus einem Polysaccharid, an das ein Protein "angehängt" ist. Der Kohlenhydrat-Anteil eines Mucoproteins liegt bei 60 bis 80%. Die Zuckerketten tragen oft negativ geladene Seitengruppen (zum Beispiel Sulfatgruppen). Diese negativen Ladungen zusammen mit den vielen OH-Gruppen der Zucker-Einheiten binden sehr viele Wasser-Moleküle. Das führt dann dazu, dass die Mucoproteine oft eine schleimige Konsistenz haben. Daher verwundert es auch nicht, dass Mucine der Hauptbestandteil von Schleimen sind, also Sekreten, die Drüsen in Organen wie Augen, Bronchien, Mund, Nase, Magen oder Darm absondern.
Die Kohlenhydrat-Ketten der Mucoproteine sind nicht so lang wie die der Proteoglycane, aber man nimmt an, dass sich die Kohlenhydrat-Ketten mehrerer Mucoprotein-Moleküle untereinander vernetzen können, so dass riesige Gebilde entstehen, die aus bis zu 20 Mucoprotein-Molekülen zusammengesetzt sind [5].
Bildung der Glycoproteine
Die Protein-Komponenten der Glycoproteine werden "ganz normal" von den Ribosomen des rauen ERs synthetisiert und gelangen in das Lumen des rauen ERs. Bereits dort werden die ersten Zuckerreste an die Proteine angehängt. Im Golgi-Apparat werden die Glycoproteine dann weiter modifiziert. Mit den Golgi-Vesikeln gelangen die fertigen Glycoproteine dann zur Zellmembran, wo sie sich durch laterale Diffusion in der Membran ausbreiten.
➥Oligosaccharid-Prozessierung im Golgi-Apparat
Auf dieser Seite wird etwas ausführlicher erläutert, wie in den Zisternen des Golgi-Apparates die Oligosaccharidketten der Glycoproteine nach und nach modifiziert werden.
Quellen:
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Wikipedia, Artikel "Glykoproteine".
- Wikipedia, Artikel "Proteoglykane"
- Wikipedia, Artikel "Mucine"