Glycoproteine
Glycoproteine sind Membranproteine, die über eine bestimmte Aminosäure mit einem Oligosaccharid aus max. 15 Zucker-Einheiten kovalent verbunden sind. Diese Oligosaccharid-Ketten entstehen natürlich nicht bei der Translation, dort werden ja nur Aminosäuren aneinandergehängt. Für die posttranslationale Modifizierung (Veränderungen der Proteine anschließend an die Translation) ist zunächst das endoplasmatische Reticulum und danach der Golgi-Apparat zuständig.
➥Glycoproteine, Endoplasmatisches Reticulum, Golgi-Apparat
Weitere Einzelheiten zu diesen drei Themen finden Sie auf den entsprechenden Seiten.
Auf dieser Seite wollen wir uns anschauen, wie die bereits teilweise glycolisierten Proteine in den Zisternen des Golgi-Apparates weiter modifiziert werden. Die Glycoproteine gelangen in ER-Vesikeln vom endoplasmatischen Reticulum zu dem sogenannten cis-Golgi-Netzwerk. Das ist eine Reihe von verzweigten und verschachtelten Golgi-Zisternen auf der cis-Seite eines Dictyosoms. Die cis-Seite ist diejenige Seite, die dem ER zugewandt ist.
Ein Dictyosom besteht aus mindestens drei Zisternen, meistens aber aus vier, fünf oder sechs. Bei manchen Protozooen (tierischen Einzellern) hat man sogar schon Dictyosomen mit bis zu 20 Zisternen gefunden [1].
Die zu modifizierenden Proteine befinden sich in der Membran der ER-Vesikel. Wenn diese mit der ersten Golgi-Zisterne auf der cis-Seite des Dictyosoms verschmelzen, gelangen die Proteine in die Membran der Zisterne.
Schrittweise Glycolysierung der Proteine
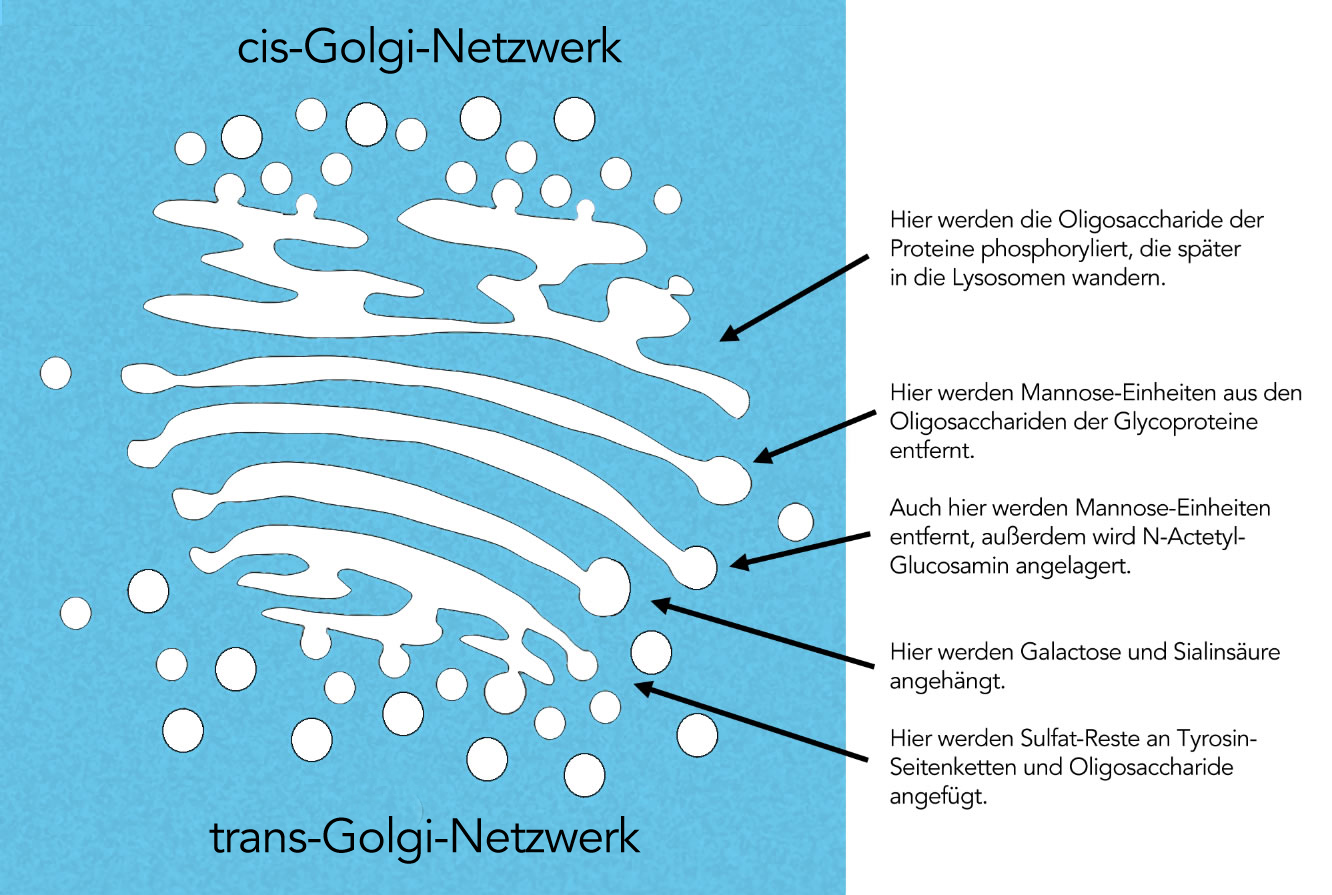
In der ersten Zisterne, die noch dem cis-Golgi-Netzwerk (CGN) angehört, werden die Oligosaccharide derjenigen Glycoproteine mit Phosphatgruppen ausgestattet (phosphoryliert), die später in die Lysosomen verfrachtet werden [1]. Auch werden hier auch die Enzyme phosphoryliert, die für die Verarbeitung der Glycoproteine zuständig sind [2].
Auf dieser Seite erfahren Sie das Wichtigste über die Lysosomen.
Prozessierung der Glycoproteine in den Zisternen des Golgi-Apparats
Autor: Ulrich Helmich, nach einer Zeichnung aus [1], Lizenz: Public domain
In der zweiten Zisterne oder der ersten Medial-Zisterne werden Einheiten des Monosaccharids Mannose aus den Oligosacchariden der Glycoproteine wieder entfernt. Diese Mannose-Einheiten wurden vorher von Enzymen des ER an die Proteine angehängt.
Auch in der dritten Zisterne werden solche Mannose-Einheiten entfernt. Andere Enzyme hängen Einheiten von N-Acetyl-Glucosamin an die Oligosaccharidketten der Glycoproteine an.
In der vierten Zisterne werden Galactose und Sialinsäure angehängt. Galactose ist ein bekanntes Monosaccharid, es ist ein Bestandteil der Lactose, des Milchzuckers. Sialinsäuren sind Derivate von Monosacchariden, die mit COOH-Gruppen, zusätzlichen C-Ketten mit OH-Gruppen sowie einer stickstoffhaltigen Seitengruppe ausgestattet sind.
In dem trans-Golgi-Netzwerk schließlich werden Sulfat-Reste an die Seitenketten von Tyrosin-Bausteinen des Proteins selbst angehängt, und außerdem an bestimmte Zucker der Oligosaccharidkette.
Wie bereits erwähnt, befinden sich die Proteine, die hier modifiziert werden, nicht in dem Lumen (dem Hohlraum) der Zisternen, sondern sind in die Membran der Zisternen integriert. Nur so können die vielen Enzyme (viele Golgi-Glycosidasen und hunderte von Golgi-Glycosyltransferasen) in den Zisternen die Oligosaccharidketten bearbeiten.
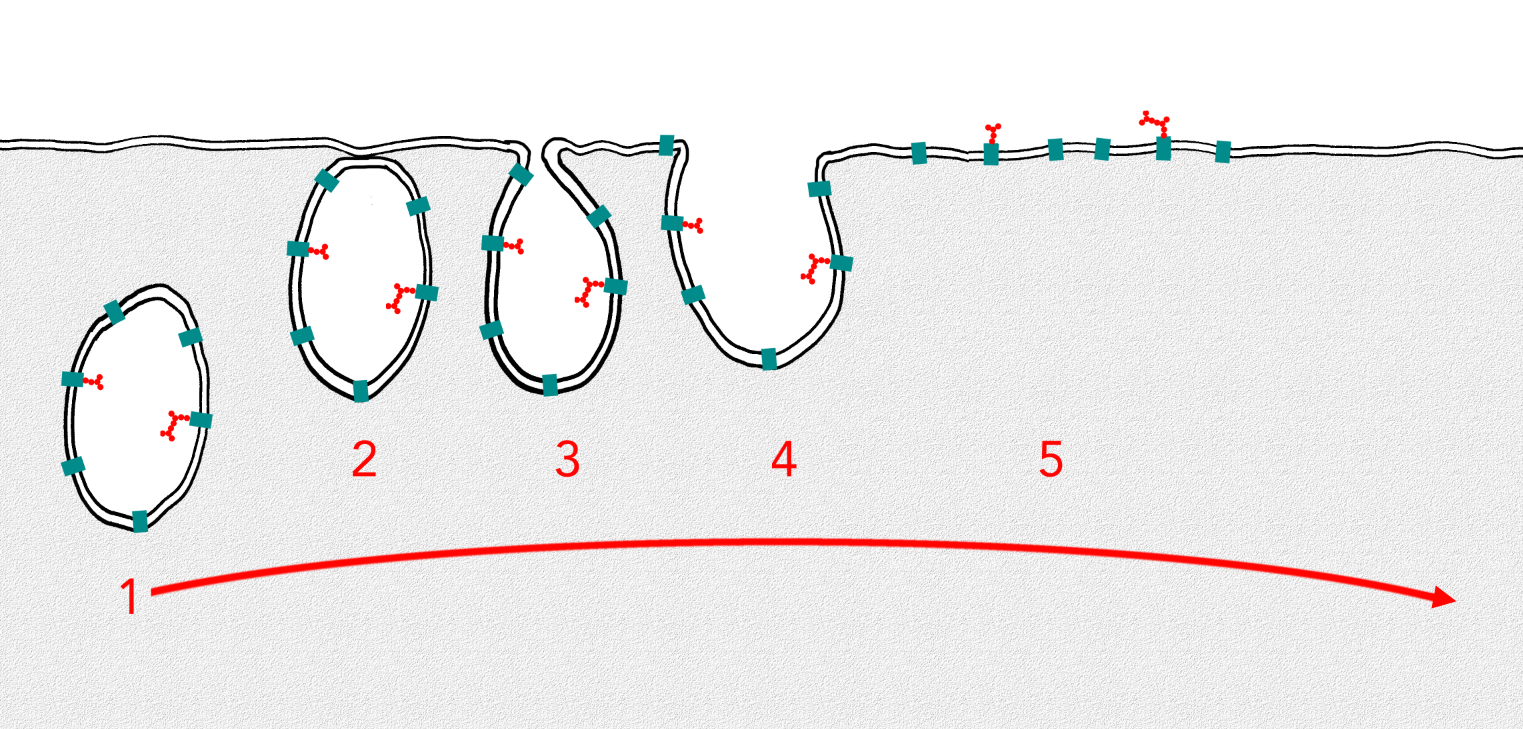
Die so modifizierten Proteine gelangen dann mit den Golgi-Vesikeln zu ihren Zielorten, beispielsweise der Zellmembran. Dort verschmelzen die Golgi-Vesikel mit der Membran, und die Glycoproteine werden auf diese Weise in die Zellmembran eingebaut.
Transport der Glycoproteine vom Golgi-Apparat zur Zellmembran
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Bei diesem Transportvorgang handelt es sich um einen exocytose-ähnlichen Vorgang, der auf der Seite "Exocytose" näher beschrieben ist.
Glycolysierung der Glycolipide
Viele der in den Membranen der ER-Vesikel integrierten Lipide sind mit Oligosaccharid-Ketten ausgestattet. Auch diese Oligosaccharid-Ketten werden im Golgi-Apparat modifiziert [2].
Wenn Sie mehr über Glycolipide wissen wollen, gehen Sie bitte auf diese Lexikon-Seite.
Quellen:
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Plattner, Hentschel. Zellbiologie, 5. Auflage. Stuttgart 2017.