Zum Begriff
Unter einer Protein-Domäne versteht man einen mehr oder weniger eigenständigen Bereich innerhalb eines Proteins, der eine bestimmte Aufgabe übernimmt, zum Beispiel Verankerung des Proteins in der Zellmembran, aktives Zentrum, allosterisches Zentrum oder Ähnliches.
Nach [1] ist eine Protein-Domäne "eine Unterstruktur, die von Teilen einer Polypeptidkette gebildet wird, die sich unabhängig vom Rest des Proteins zu einer kompakten, stabilen Struktur falten können".
Protein-Domänen bestehen aus 30 bis 400 Aminosäuren [2], die meisten Domänen umfassen 100 bis 200 Aminosäuren [3].
Den Begriff "Domäne" für solche Proteinabschnitte hat übrigens Jane S. Richardson, eine US-amerikanische Biochemikerin, im Jahre 1981 geprägt [4, 5].
Ein Protein kann aus einer einzelnen Domäne bestehen, dann redet man allerdings nicht von einer "Domäne". Die meisten größeren Proteine bestehen jedoch aus mehreren Domänen, [1] spricht von bis zu "mehreren Dutzend". Eine Domäne besteht immer aus einem zusammenhängenden Teil der Peptidkette. Das hängt eventuell damit zusammen, dass in einigen Fällen (aber nicht immer) Beziehungen zwischen Domänen und Exons bestehen. Dabei ist jedes Exon des entsprechenden eukaryotischen Gens für eine bestimmte Domäne des Proteins verantwortlich.
Multidomänen-Proteine
Multidomänen-Proteine, also Proteine mit mehr als einer Domäne, sind vermutlich durch zufällige Neukombination von Exons oder allgemein DNA-Abschnitten entstanden, deren Protein-Ergebnis dann nicht durch die Selektion benachteiligt wurde.
Bei solchen Multidomänen-Proteinen sind die einzelnen Domänen durch unregelmäßige Peptid-Abschnitte miteinander verbunden. Diese unregelmäßigen kurzen Abschnitte sind sehr beweglich und wirken daher wie eine Art Scharnier zwischen den weniger beweglichen Domänen [1].
Diese "Scharniere" verleihen dem Protein nicht nur eine größere Beweglichkeit, sondern dienen oft auch als Andockstellen für kleinere Moleküle [1].
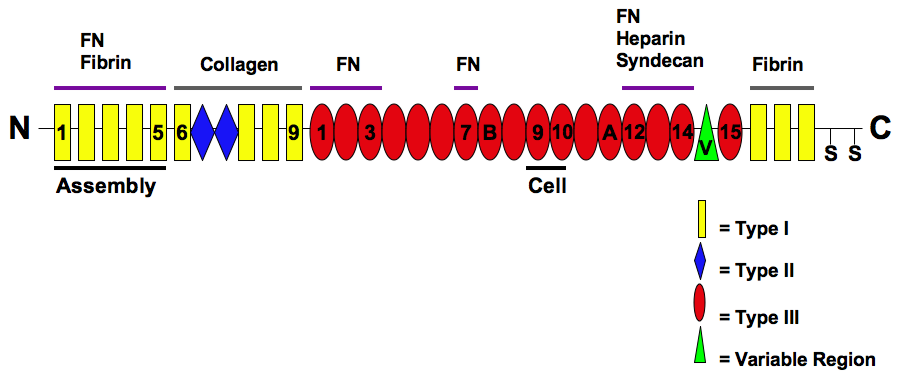
Die Struktur von Fibronektin und seine Domänen
AllWorthLettingGo, CC BY-SA 3.0, via Wikimedia Commons
Hier sehen wir eine schematische Darstellung des Fibronektin-Moleküls. Dieses Protein setzt sich aus mehreren Domänen zusammen, die unterschiedliche Funktionen haben. Eine Domäne ist für die Bindung an Fibrin verantwortlich, eine andere für die Bindung an Kollagen. Besonders interessant ist der rot gekennzeichnete Abschnitt, das Typ-III-Modul. Laut [1] setzt sich dieses Modul nämlich aus vier fast identischen kurzen Domänen zusammen, die vermutlich durch Gen-Duplikation eines entsprechenden DNA-Abschnitts entstanden sind.
"Steife gestreckte Strukturen, die aus hintereinanderliegenden Modulen zusammengesetzt sind, kommen besonders häufig in Molekülen der extrazellulären Matrix und in den extrazellulären Anteilen von Zelloberflächen-Rezeptorproteinen vor." [1].
zum Biologie-Unterricht
Für den Biologie-Unterricht ergeben sich aus der Tatsache, dass es Protein-Domänen gibt, durchaus Konsequenzen. Hat man den Schüler(innen) bisher beigebracht, dass es vier Hierarchieebenen der Proteine gibt, nämlich Primärstruktur, Sekundärstruktur, Tertiärstruktur und Quartärstruktur, so müsste man jetzt zwischen Sekundärstruktur und Tertiärstruktur die Proteindomänen als weitere Hierarchieebene einschieben. Eine Proteindomäne besteht nämlich meistens aus mehreren alpha-Helices und/oder mehreren beta-Faltblättern und ist somit der Sekundärstruktur übergeordnet, aber der Tertiärstruktur untergeordnet.
Domänen sind Universal-Bausteine
Das Interessante an den Proteindomänen ist Folgendes: Proteindomänen sind eine Art Universal-Baustein für Proteine. Löst man eine Domäne experimentell aus einem Protein heraus, so behält sie oft ihre typische Funktion bei, sie kann also mehr oder weniger unabhängig vom Protein arbeiten.
Bestimmte Domänen kommen auch in über 100 verschiedenen Proteinen vor, wo sie dann die gleiche oder zumindest eine vergleichbare Funktion übernehmen [3]. Beispiele für solche Aufgaben sind:
- das Verankern des Proteins in der Zellmembran (zum Beispiel durch sieben alpha-Helices),
- das Aufnehmen einer Phosphatgruppe, um das Protein zu aktivieren,
- das Spalten einer Ester-Bindung, um zum Beispiel ein Substrat zu hydrolysieren,
- die Aktivierung eines benachbarten G-Proteins,
- die Kontaktaufnahme mit einem bestimmten Abschnitt der DNA, um Gene zu aktivieren.
Das waren jetzt nur fünf Beispiele. Proteindomänen haben aber noch viel mehr Aufgaben, die hier nicht alle aufgezählt werden können.
Evolution der Domänen
Einige Domänen kommen sowohl in Archaeen wie in Bakterien und Eukaryoten vor. Also muss bereits der gemeinsame Vorfahr dieser Gruppen diese Domänen besessen haben. Diese "uralten" Domänen haben meistens wichtige Aufgaben bei der enzymatischen Katalyse von Stoffwechsel-Prozessen und bei der Protein-Protein-Interaktion [6].
Die Existenz von Domänen hat die Evolution der Eukaryoten erheblich beschleunigt, vor allem was die Herausbildung der enormen Diversität der Eukaryoten angeht. Interessanterweise haben sich die meisten Protein-Domänen der Eukaryoten lange vor der Entstehung der Wirbeltiere gebildet. Nur ca. 7% der Proteinfamilien des Menschen kommen ausschließlich in Wirbeltieren vor, die restlichen 93% haben wir von den Wirbeltier-Vorfahren geerbt [7].
Eukaryoten kommen zwar als Einzeller vor (zum Beispiel Protozoen wie die Wimperntierchen oder Amöben), aber höhere Eukaryoten (Pflanzen, Tiere, Pilze) sind Vielzeller. Bei Vielzellern müssen die einzelnen Zellen miteinander ständig kommunizieren. Proteine mit extrazellulären Domänen, die auf Botenstoffe reagieren oder die mit extrazellulären Domänen benachbarter Zellen Kontakt aufnehmen, waren daher sehr vorteilhaft [6].
Domain shuffling
Wie kommen neue Domänen in ein Protein hinein? Die Antwort auf diese Frage ist der englische Begriff "domain shuffling".
"Although some bacteria have acquired domains from eukaryotic species by horizontal gene transfer, it is through the duplication, insertion, and deletion of genes that proteins principally acquire or lose domains and by which new combinations are generated. The process is termed domain shuffling. One way in which this occurs is through the shuffling of exons (again through insertion, duplication, or deletion). " [6]
Man nimmt an, das jede Domäne eines eukaryotischen Proteins durch ein Exon innerhalb des Gens codiert wird. Durch Neukombination solcher Exons (Exon shuffling) entstehen dann bei der Translation neue Proteine mit neuen Domänen-Kombinationen, die sich in der Evolution durchsetzen, wenn sie einen Selektionsvorteil bieten.
Quellen:
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Berg, Tymoczko, Stryer: Biochemie. 6 Auflage, Heidelberg 2007.
- Wikipedia, Artikel "Proteindomäne".
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Wikipedia, Artikel "Jane Richardson".
- Gomperts, Kramer, Tatham: Signal Transduction, 2. Edition, Elsevier 2009.
- Choudhuri, Fundamentals of Molecular Evolution, in Bioinformatics for Beginners, Elsevier 2014.