Biotin
Vitamin B7, bekannter als Biotin, spielt eine wichtige Rolle im Stoffwechsel der Kohlenhydrate, Fettsäuren, Aminosäuren und Purine [1].
Struktur des Biotin-Moleküls

Strukturformel von Biotin und seinen Komponenten
Autor: Ulrich Helmich 10/2023, Lizenz: CC BY-NC-SA 4.0
Oben sehen wir die Strukturformel von Biotin. Strukturmäßig setzt sich das Biotin-Molekül aus drei Komponenten zusammen:
- Harnstoff
- Thiophen
- Pentansäure (Valeriansäure)
Die Pentansäure hat eine sehr wichtige Funktion in dem Biotin-Molekül, mit der COOH-Gruppe der Pentansäure verbindet sich das Biotin-Molekül kovalent mit einem Lysin-Rest eines Proteins. Biotin ist somit die prosthetische Gruppe einiger Enzyme.
Für Chemie-Profis
Es gibt acht mögliche Stereoisomere des Biotin-Moleküls, von denen aber nur eine biologisch aktiv ist, nämlich das D(+)-Biotin, dessen Raumstruktur wir uns jetzt mal näher anschauen:

Raumstruktur des D(+)-Biotin-Moleküls
Mysid, Public domain, via Wikimedia Commons
Die beiden H-Atome an der Schnittstelle zwischen Harnstoff und Thiophen sind auf der Zeichnung nach "vorne" gerichtet, während die Pentansäure nach "hinten" ausgerichtet ist.
Wieso gibt es genau acht verschiedene Stereoisomere des Biotins?
Das kann man ganz einfach nachvollziehen. Die beiden H-Atome am Thiophen-Ring können
- beide "vorne" sein,
- beide "hinten" sein,
- das linke "vorne", das rechte "hinten" sein,
- das linke "hinten", das rechte "vorne" sein.
Damit hätten wir schon einmal vier Möglichkeiten der räumlichen Anordnung. Dann kommt ja noch die Stellung der Pentansäure dazu, die auch
- nach "vorne" gerichtet
- nach "hinten" gerichtet
sein kann. Insgesamt sind das also acht verschiedene Möglichkeiten, die beiden H-Atome und die Pentansäure räumlich anzuordnen. Die Begriffe "vorne" und "hinten" stehen in Anführungszeichen, weil es in Wirklichkeit ja sinnlos ist, bei Molekülen, die sich ständig um alle drei Achsen im Raum drehen, von vorne und hinten zu sprechen. Die Richtungsangaben beziehen sich ausschließlich auf die Zeichnung.
Aufgaben von Biotin
Biotin ist Bestandteil von Enzymen, die für die Übertragung von COOH-Gruppen zuständig sind. Während dieser Übertragung wird die Carboxygruppe unter ATP-Verbrauch an eines der beiden N-Atome der Biotin-Komponente des Enzyms gehängt. Anschließend wird die COOH-Gruppe (meistens als COO-) auf das Ziel-Molekül übertragen [1].
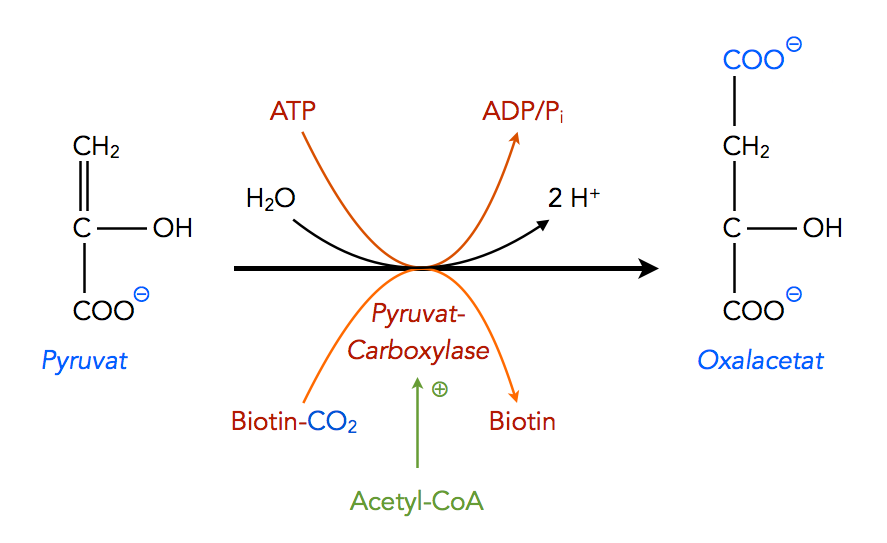
Die Carboxylierung von Pyruvat zu Beginn der Gluconeogenese
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Die Carboxylierung von Pyruvat zu Oxalacetat während der Gluconeogenese ist eine dieser COOH-Übertragungen, die unter Mithilfe von Biotin stattfinden.
Neben der Pyruvat-Carboxylase gibt es noch drei weitere wichtige Enzyme, die Biotin als prosthetische Gruppe benötigen [3], nämlich
- Propionyl-CoA-Carboxylase (Verstoffwechselung von Aminosäuren und Fettsäuren mit ungeradzahligen oder verzweigten Ketten)
- Methylcrotonyl-CoA-Carboxylase (Verstoffwechselung der Aminosäure Leucin)
- Acetyl-CoA-Carboxylase (Lipogenese)
Aufnahme in den Körper
Biotin ist eine prosthetische Gruppe bestimmter Carboxylasen, also von Enzymen, die COOH-Gruppen übertragen.
Unter einer prosthetischen Gruppe versteht man ein Molekül, das nicht aus Aminosäuren aufgebaut ist, und das kovalent an ein Protein gebunden ist und auch eine wichtige Rolle für das Protein spielt.
Eine bekannte prosthetische Gruppe ist beispielsweise die Häm-Komponente, die an das Protein Globin gebunden ist (zusammen bilden das Häm und das Globin dann den roten Blutfarbstoff Hämoglobin).
Aus diesem Grund kommt Biotin in Lebensmitteln auch nicht in freier Form vor, sondern ist immer an ein Protein gebunden. Im Dünndarm werden diese Proteine aufgespalten, und das Enzym Biotinidase (eine Hydrolase) spaltet dann das Biotin-Molekül aus dem Protein ab [2].
Wie bei vielen anderen wasserlöslichen B-Vitaminen erfolgt die Aufnahme in die Zellen des Dünndarmepithels dann entweder über passive Diffusion (wenn die Biotin-Konzentration hoch ist) oder über einen Na+-gesteuerten aktiven Transport (bei niedrigen Biotin-Konzentrationen). Das entsprechende Carrierprotein wird als Natriumabhängiger Multivitamin-Transporter bezeichnet.
Im Blut wird Biotin teils in freier, teils in gebundener Form transportiert. Wenn das Biotin dann in die Zielzellen transportiert wurde, wird es durch das Enzym Holocarboxylase-Synthetase als prosthetische Gruppe an eine entsprechende Carboxylase gekoppelt [2].
Holocarboxylase-Synthetase-Mangel (HCS)
Wenn das Gen für dieses Enzym mutiert ist, kann es zur Erbkrankheit Holocarboxylase-Synthetase-Mangel (HCS) kommen. Da die Holocarboxylase-Synthetase dann nicht mehr korrekt arbeitet, können auch keine Biotin-Moleküle mehr als prosthetische Gruppe an die Carboxylasen gehängt werden. Und wenn diesen wichtigen Enzymen ihre prosthetische Biotin-Gruppe fehlt, können diese natürlich auch nicht mehr richtig arbeiten.
Die Erbkrankheit ist nicht sehr verbreitet, rein statistisch gesehen hat einer von 200.000 Menschen diese Krankheit. Auf Deutschland hochgerechnet wären das also gut 400 Menschen, die von dieser Krankheit betroffen sind. Die Krankheit wird autosomal-rezessiv vererbt [3].
Biotinidase-Mangel
Hierbei handelt es sich ebenfalls um eine autosomal-rezessive Erbkrankheit. Diese tritt dann auf, wenn das Gen für das Enzym Biotinidase mutiert ist. Inzwischen kennt man über 60 verschiedene Mutationen des Gens, die zu dieser Krankheit führen.
Wenn dem Körper dieses Enzym fehlt oder nicht in ausreichendem Maße vorhanden ist, kann das mit der Nahrung aufgenommene Biotin nicht verwertet werden. Wie wir oben weiter gesehen haben, spaltet die Biotinidase ja das Biotin von den Proteinen ab, die wir mit der Nahrung aufgenommen haben.
Diese Erbkrankheit kann leicht behandelt werden, indem man ständig Biotin zuführt [4].
Vorkommen in Lebensmitteln und Bedarf
Biotin kommt hauptsächlich in folgenden Nahrungsmitteln vor [2]:
- Bierhefe (115 µg / 100 g)
- Rinderleber gegart (100 µg / 100 g)
- Kalbsleber gegart (75 µg / 100 g)
- Erdnussbutter (67 µg / 100 g)
Es gibt noch nicht viele Zahlen zum Biotin-Bedarf des Menschen. Man hat aber beobachtet, dass keine Mangelerscheinungen auftreten, wenn man durchschnittlich 30 bis 60 µg Biotin täglich zu sich nimmt [2]. Säuglinge und Kinder benötigen weniger Biotin, Säuglinge 5 - 10 µg / Tag und Kinder und Jugendliche 10 - 35 µg / Tag [2].
Der Biotin-Gehalt einer normalen gemischten Kost liegt bei 50 bis 200 µg / Tag [1].
Überschüssige Biotin wird mit dem Harn ausgeschieden.

Vitamin B7 ist auch ein beliebtes Nahrungsergänzungsmittel
Screenshot der Google-Suche nach Vitamin B7
Wenn man im Internet nach "Vitamin B7" sucht, fällt vor allem die viele Werbung für Biotin als Nahrungsergänzungsmittel auf. Bei den entsprechenden Symptomen (siehe unten) mag das sinnvoll sein, ansonsten sind solche Präparate hauptsächlich "Zutaten für besonders teuren Urin".
Mangelerscheinungen
Mangelsymptome treten bei Erwachsenen nicht so oft auf, weil Biotin fast in allen pflanzlichen und tierischen Lebensmitteln vorkommt. Durch genetische Defekte (siehe Kästen im Text oben) kann es allerdings zu Störungen des Biotin-Haushaltes kommen.
Es gibt allerdings eine Möglichkeit, einen Biotin-Mangel herbeizuführen. Eine Kost, die zu mehr als 30% aus rohem Hühnereiklar besteht, kann zu Biotin-Mangel führen. Das Hühnereiklar enthält nämlich ein Protein, das mit Biotin eine Komplexverbindung eingehen kann, wodurch das Vitamin dann nicht mehr zur Verfügung steht [1].
Erste Symptome für einen Biotin-Mangel sind Veränderungen der Haut: schuppende Dermatitis, verbunden mit Haarausfall [2]. Auch brüchige Fingernägel können ein Indiz für einen Biotin-Mangel sein. Und hier ist es tatsächlich so, dass die Einnahme von Biotin-Produkten ein Abklingen der Symptome bewirkt [2].
Hypervitaminose
Biotin-Hypervitaminosen sind nicht bekannt [1].
Quellen:
- Schlieper, Grundfragen der Ernährung, 21. Auflage, Hamburg 2014.
- Hahn et al., Ernährung, 3. Auflage, Stuttgart 2016.
- Wikipedia-Artikel "Holocarboxylase-Synthetase-Mangel"
- Wikipedia-Artikel "Biotinidase-Mangel"