Betrachten wir folgendes Energiediagramm:
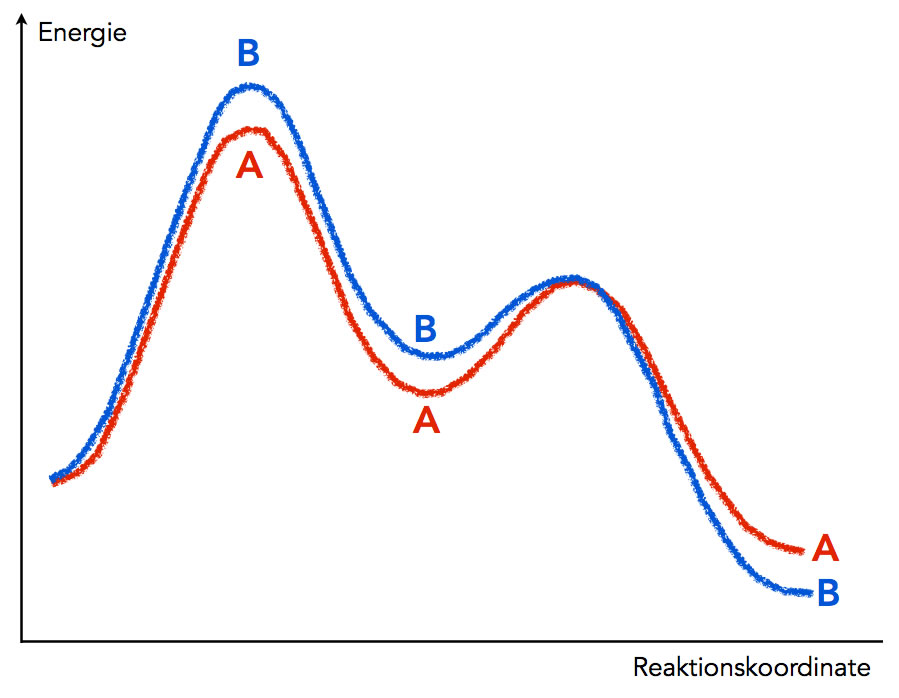
Zwei ähnliche Reaktionsverläufe A und B
Das Diagramm zeigt zwei ähnliche chemische Reaktionen, die in jeweils zwei Schritten verlaufen. Beispielweise könnte es sich um eine SN1-Reaktion handeln: Im ersten Schritt wird ein Brom-Anion aus einem Bromalkan abgespalten, im zweiten Schritt lagert sich ein Nucleophil an das entstandene Carbenium-Ion an. Oder es könnte sich um eine elektrophile Substitution handeln: Im ersten Schritt lagert sich das Elektrophil an den Benzolring an, im zweiten Schritt spaltet sich ein Proton ab, um den aromatischen Charakter wieder herzustellen.
Wie unterscheiden sich die beiden Reaktionen A und B voneinander?
Bei B ist die Aktivierungsenergie des ersten Schrittes höher als bei A, dafür ist die Reaktionsenthalpie bei B insgesamt negativer als bei A. Man könnte also A charakterisieren als exotherme Reaktion mit niedriger Aktivierungsenergie, und B als stark exotherme Reaktion mit hoher Aktivierungsenergie.
Was hat das nun mit dem Titel dieser Seite zu tun: Kinetische Kontrolle?
Angenommen, A und B sind Konkurrenzreaktionen. Die Edukte sind bei A und B also gleich, aber es entstehen unterschiedliche Produkte.
Bei niedrigen Temperaturen kommt es auf die Aktivierungsenergie des geschwindigkeitsbestimmenden Schrittes an. Das ist immer der Schritt mit der höchsten Aktivierungsenergie, in diesem Fall also der erste Reaktionsschritt. Die Aktivierungsenergie von A ist niedriger als die von B, also wird bei niedrigen Temperaturen die Reaktion A schneller ablaufen als die Konkurrenzreaktion B.
Wie ist es aber bei hohen Temperaturen?
Bei einer hohen Temperatur ist es völlig egal, wie hoch die Aktivierungsenergie eines Schrittes ist. Es ist für jeden Aktivierungsberg stets genügend Energie vorhanden, der Unterschied zwischen A und B ist daher bedeutungslos. Jetzt kommt der Unterschied in der Reaktionenthalpie zum Tragen. Bei der Reaktion B wird mehr Energie freigesetzt als bei der Reaktion A. Daher wird B begünstigt - aber nur bei hohen Temperaturen.
Kommen wir nun endlich zum Thema "Kinetische Kontrolle"
Wenn der Verlauf einer Reaktion von der Aktivierungsenergie des geschwindigkeitsbestimmenden Schrittes abhängt, spricht man von kinetischer Kontrolle. Bei unserem Beispiel kommt die kinetische Kontrolle bei niedrigen Temperaturen zum Zuge.
Das Gegenteil von kinetischer Kontrolle ist die thermodynamische Kontrolle. Eine thermodynamische Kontrolle liegt vor, wenn der Verlauf der Reaktion von der Reaktionsenthalpie bestimmt wird. Bei unserem Beispiel ist das bei hohen Temperaturen der Fall.
Laut dem Lexikon der Chemie (Spektrum-Verlag) ist die Ursache für eine kinetische Kontrolle "das Auftreten von Hemmungserscheinungen, die das Erreichen des thermodynamischen Gleichgewichts verzögern oder praktisch vollständig unterbinden. Bei Parallelreaktionen kann dies zur Selektivität führen".
Ist die kinetische Kontrolle abiturrelevant?
Ich weiß es ehrlich gesagt nicht. Aber in den Lehrermaterialien zum aktuellen Schroedel-Band "Chemie heute Qualifikationsphase" gibt es eine schöne Aufgabe zu diesem Thema, wenn dort auch nicht direkt von kinetischer Kontrolle gesprochen wird. Es geht um die Mono-Bromierung von Naphthalin, die nach dem Mechanismus der elektrophilen Substitution abläuft. Es können sich zwei Reaktionsprodukte bilden, das 1-Brom-naphthalin und das 2-Brom-naphthalin. Die Bildung des 1-Brom-naphthalins ist sterisch etwas gehemmt, weil sich das dicke Brom-Atom in die Nähe des zweiten Benzolrings setzen muss. Daher ist die Aktivierungsenergie für die Addition des Brom-Kations recht hoch. Bei niedrigen Temperaturen bildet sich dieses Reaktionsprodukt nicht so leicht. Bei der Bildung von 2-Brom-Naphthalin gibt es diese sterische Hemmung nicht, die Aktivierungsenergie für diesen Reaktionsschritt ist also niedriger als die für die 1-Brom-naphthalin-Bildung.
Bei hohen Temperaturen entsteht allerdings bevorzugt 1-Brom-Naphthalin, weil die Reaktionsenthalpie dieser Reaktion negativer ist als bei der Bildung von 2-Brom-Naphthalin. Hier herrscht jetzt keine kinetische Kontrolle mehr, weil bei hohen Temperaturen die Aktivierungsenergien keine Rolle mehr spielen.