Nach der von Erich Hückel (1896-1980) um 1930 aufgestellten Regel ist eine Verbindung dann aromatisch, wenn folgende Bedingungen erfüllt sind:
- Das Molekül ist ringförmig.
Dabei ist es egal, ob der Ring aus 3, 4, 5, 6, 7 oder mehr Atomen besteht. Es ist auch egal, ob es sich um C-Atome oder um andere Atome (beispielsweise N, S oder O wie bei den Heterocyclen) handelt.
- Alle Atome des Ringes sind sp2-hybridisiert.
Entscheidend ist hier, dass jedes Ring-Atom ein pz-Orbital zur Verfügung stellt, in dem sich π-Elektronen aufhalten können. In diesem System aus pz-Orbitalen darf keine Lücke sein. Ein sp3-hybridisiertes Atom würde zum Beispiel eine solche Lücke erzeugen, weil es kein pz-Orbital zur Verfügung stellt.
- Der Ring ist planar.
Das heißt, alle Atome des Ringes liegen in einer Ebene. Auf diese Weise können die pz-Orbitale der Ringatome maximal überlappen.
- Die Anzahl der π-Elektronen in dem Ringsystem gehorcht der Regel (4n + 2).
Für Benzol (6 π-Elektronen) hat n den Wert 1, für Naphthalin (10 π-Elektronen) den Wert 2. Ein Ring aus 8 C-Atomen mit 4 Doppelbindungen hätte 8 π-Elektronen, die Zahl 8 erfüllt nicht die Bedingung (4n+2), daher wäre diese Verbindung nicht aromatisch.
Aromatische Verbindungen, die der Hückel-Regel genügen, sind sehr stabil und versuchen auch bei chemischen Reaktionen, diesen energetisch günstigen Zustand zu erhalten.
Schauen wir uns dazu einmal ein paar wichtige aromatische Heterocyclen an:
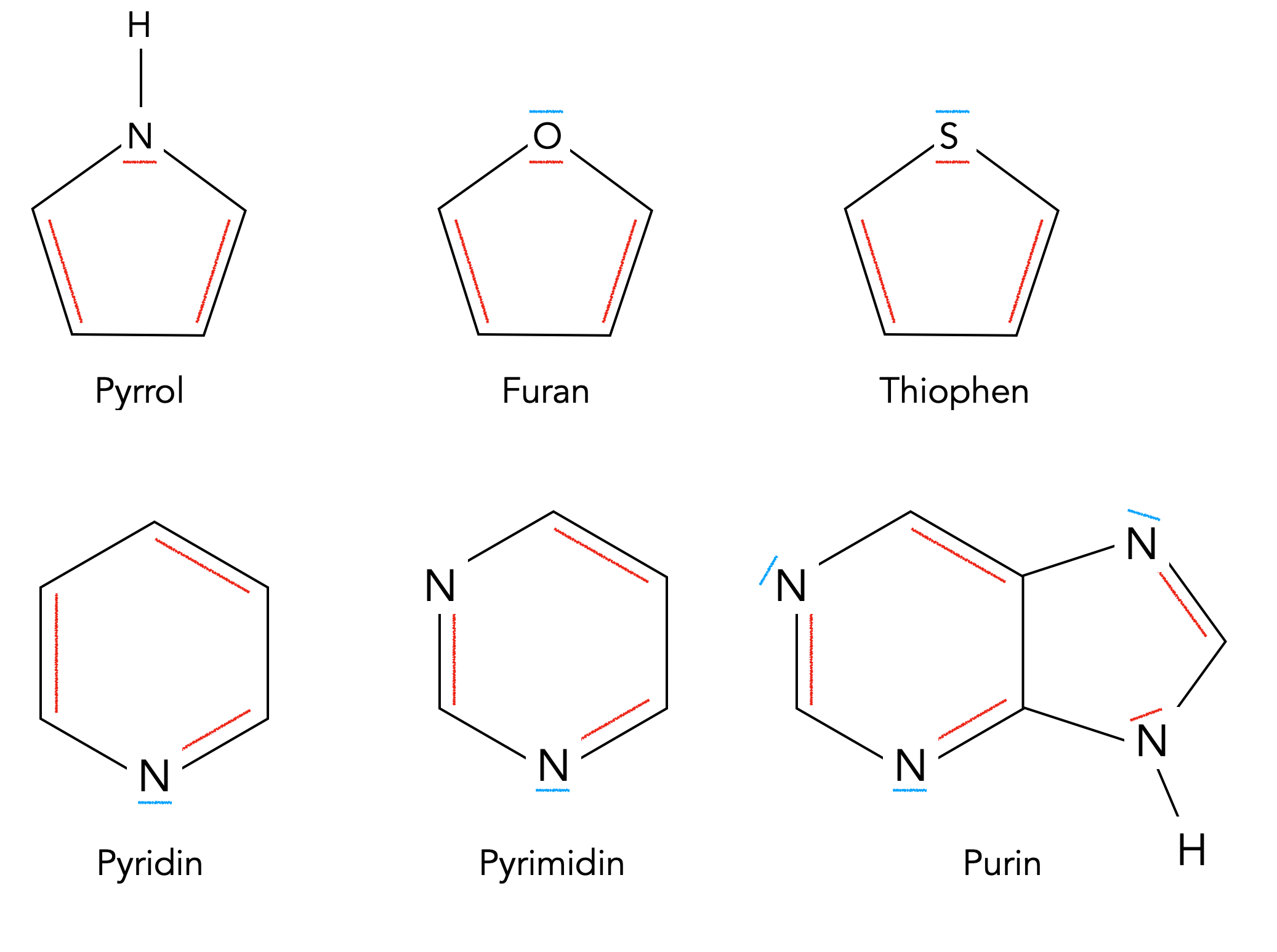
Einige bekannte aromatische Heterocyclen
Autor: Ulrich Helmich 12/2023, Lizenz: Public domain
Die an dem aromatischen π-System beteiligten Doppelbindungen und freien Elektronenpaare sind hier in rot eingezeichnet, Elektronenpaare, die nicht am aromatischen System beteiligt sind, in blau.
Beim Pyrrol besteht das π-System aus 6 Elektronen. Vier davon kommen von den beiden C=C-Doppelbindungen, die beiden anderen sind das freie Elektronenpaar des Stickstoff-Atoms. Das Molekül ist planar, und alle Ring-Atome sind sp2-hybridisiert - auch das N-Atom, obwohl es hier nur dreibindig ist wie beispielsweise im NH3-Molekül und man daher eigentlich von einer sp3-Hybridisierung ausgehen sollte. Aber offensichtlich ist die sp2-Hybridisierung hier energetisch vorteilhafter, da so ein aromatischer Zustand erreicht werden kann.
Interessant ist das Furan-Molekül. Das Hetero-Atom O hat zwei freie Elektronenpaare. Eines davon ist am π-System beteiligt, das hier auch auf 6 Elektronen kommt, das andere befindet sich außerhalb dieses Systems und kann dann von Lewis-Säuren angegriffen werden bzw. das Furan-Molekül kann als Lewis-Base fungieren.
Bei den anderen Heterocyclen sieht man durch die Farbgebung schnell, dass auch hier die (4n+2)-Regel erfüllt wird.
Beim Purin haben wir vier C=C-und C=N-Doppelbindungen, das macht dann 8 π-Elektronen. Zwei weitere π-Elektronen werden durch das Wasserstoff tragende N-Atom beigesteuert. Diese 10 π-Elektronen erfüllen dann die (4n+2)-Bedingung für n=2.
Weitere Beispiele für Verbindungen, die die Hückel-Regel erfüllen und auch Gegenbeispiele finden Sie auf dieser Seite in dem Aromatenchemie-Kurs auf dieser Homepage.
Quellen:
- RÖMPP Chemie-Lexikon, 9. Auflage, Band 1 (1989), S. 41.