Wann ist ein Aromat ein Aromat?
Nicht nur Benzol und die direkten Benzol-Derivate wie Toluol, Phenol etc. gehören zu den Aromaten, sondern auch viele andere Verbindungen, die teilweise nur entfernt aussehen wie Benzol.
Nach der von Erich Hückel (1896-1980) um 1930 aufgestellten Regel (Hückel-Regel), ist eine Verbindung dann aromatisch, wenn folgende Bedingungen erfüllt sind:
- Das Molekül ist ringförmig.
Dabei ist es egal, ob der Ring aus 3, 4, 5, 6, 7 oder mehr Atomen besteht. Es ist auch egal, ob es sich um C-Atome oder um andere Atome (beispielsweise N, S oder O) handelt.
- Alle Atome des Ringes sind sp2-hybridisiert.
Entscheidend ist hier, dass jedes Ring-Atom ein pz-Orbital zur Verfügung stellt, in dem sich pi-Elektronen aufhalten können. In diesem System aus pz-Orbitalen darf keine Lücke sein. Ein sp3-hybridisiertes Atom würde zum Beispiel eine solche Lücke erzeugen, weil es kein pz-Orbital zur Verfügung stellt.
- Der Ring ist planar.
Das heißt, alle Atome des Ringes liegen in einer Ebene. Auf diese Weise können die pz-Orbitale der Ringatome überlappen.
- Die Anzahl der π-Elektronen in dem Ringsystem gehorcht der Regel (4n + 2).
Für Benzol hat n also den Wert 1, für Naphthalin den Wert 2. Ein Ring aus 8 C-Atomen mit 4 Doppelbindungen hätte 8 π-Elektronen, die Zahl 8 erfüllt nicht die Bedingung (4n+2), daher wäre diese Verbindung nicht aromatisch.
- Die pi-Elektronen sind alle über den Ring delokalisiert.
Das heißt, jedes π-Elektron kann sich in jedem pz-Orbital aufhalten, solange die Anzahl von 2 Elektronen pro Orbital nicht überschritten wird.
Aromatische Verbindungen, die der Hückel-Regel genügen, sind sehr stabil und versuchen auch bei chemischen Reaktionen, diesen energetisch günstigen Zustand zu erhalten.
Beispiel Biphenyl
Schauen wir uns einmal die Verbindung Biphenyl bzw. die Moleküle dieser Verbindung an. Biphenyl-Moleküle kann man beschreiben als zwei Benzolringe, die über eine C-C-Bbindung miteinander verbunden sind.
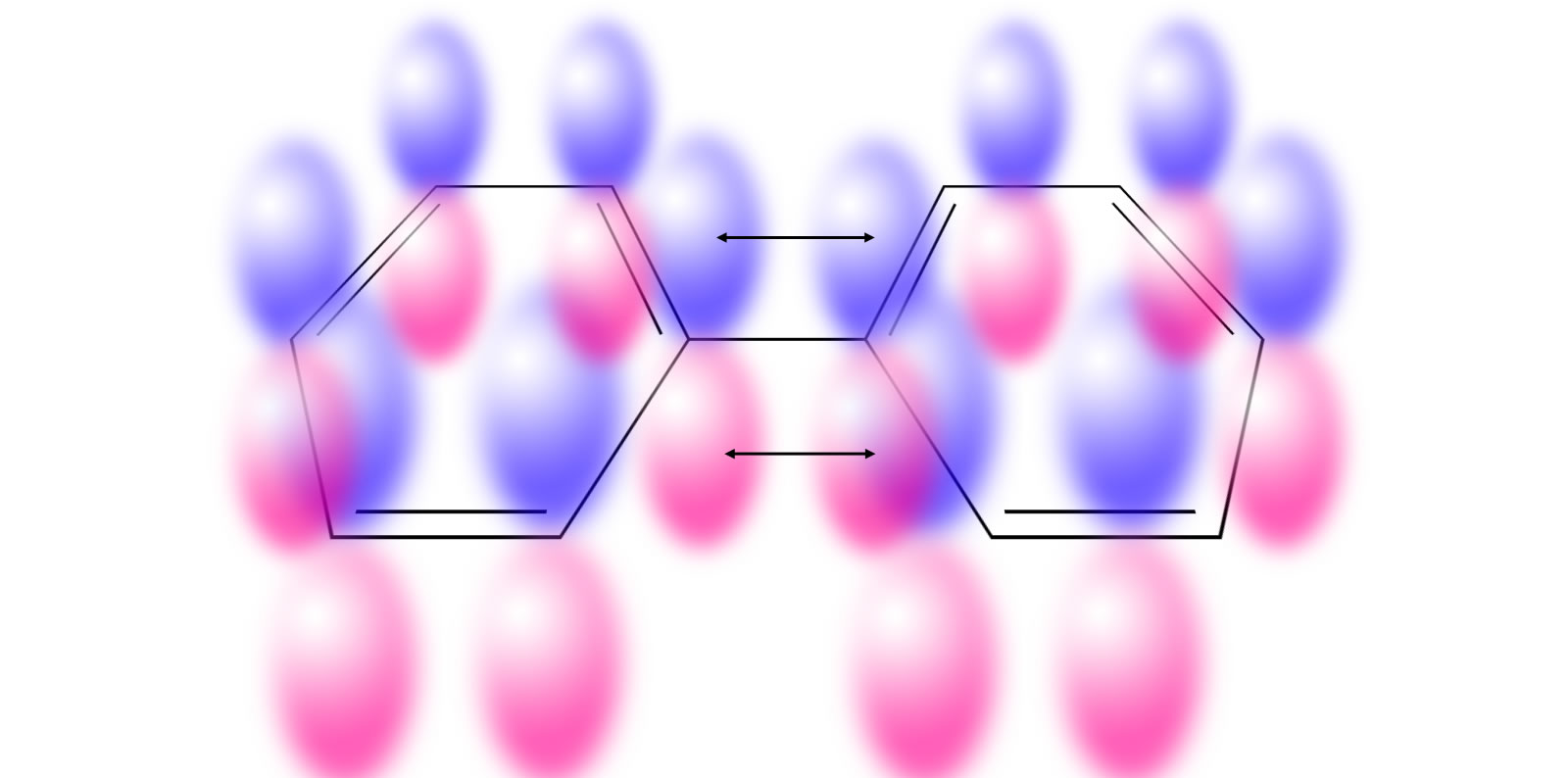
Das Biphenyl-Molekül mit seinen pz-Orbitalen
Wie man auf dieser Abbildung gut sehen kann, besteht Biphenyl aus zwei Benzol-Ringen. Jeder Ring für sich ist aromatisch, daher ist auch Biphenyl ein Aromat. Die Hückel-Regel bezieht sich immer auf ein Ringsystem, nicht auf das ganze Molekül. Jeder Ring hat 6 Elektronen und erfüllt daher mit n=1 die Hückel-Regel.
Beispiel Cyclooctatetren
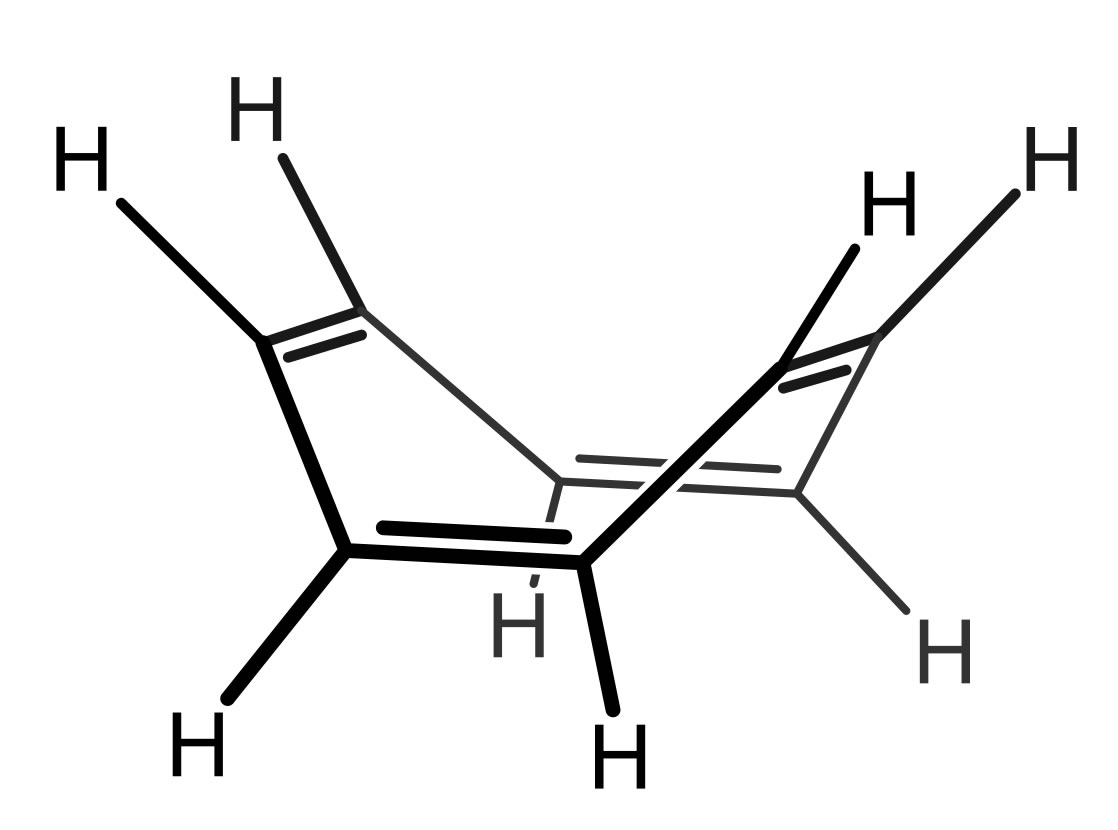
Cyclooctatetraen
Das Cyclooctatetraen-Molekül erfüllt die Hückel-Regeln nicht!
Zwar ist das Molekül ringförmig, damit ist Regel 1 erfüllt, und alle C-Atome sind sp2-hybridisiert, womit auch die zweite Regel erfüllt ist. Allerdings ist der Ring nicht planar, wie man auf der Abbildung gut sehen kann, damit ist die dritte Regel nicht erfüllt. Die pz-Orbitale können nur jeweils paarweise überlappen, es kann sich aber kein System aus allen 8 pz-Orbitalen bilden. Die vierte Regel ist ebenfalls nicht erfüllt, denn es gibt kein n, für das 4n+2 = 8 gilt. Wegen der unvollständigen Überlappung der pz-Orbitale sind die 8 pi-Elektronen auch nicht über den ganzen Ring delokalisiert, sondern bleiben in der jeweiligen Doppelbindung lokalisiert.
Beispiel Cyclopentadien
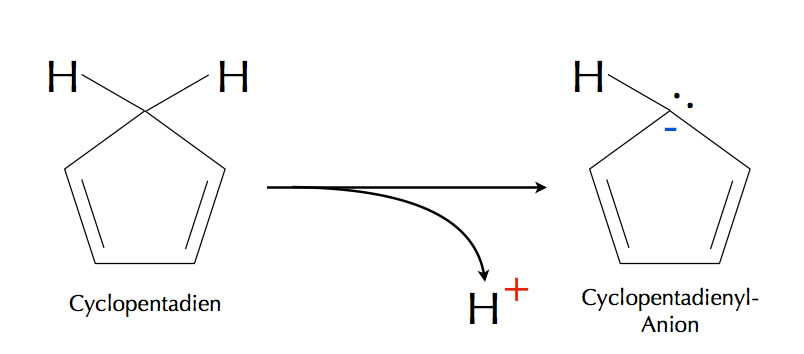
Das Cyclopentadien-Molekül und sein Anion
Das Cyclopentadien-Molekül erfüllt die Hückel-Regeln nicht!
Zwar ist das Molekül ringförmig, damit ist Regel 1 erfüllt, aber nicht alle C-Atome sind sp2-hybridisiert, damit ist Regel 2 nicht erfüllt. Das "obere" C-Atom im Bild links ist nämlich sp3-hybridisiert. Der Ring ist zwar weitgehend planar (Regel 3), aber es gibt kein n mit 4n+2 = 4, womit die 4. Regel nicht erfüllt ist. Wegen der Lücke im sp2-Ring ist auch Regel 5 nicht erfüllt.
In Anwesenheit einer starken Base kann das Cyclopentadien ein Proton relativ leicht abgeben, es wirkt also wie eine schwache Säure. Der pKS-Wert von Cyclopentadien liegt bei 16[2]. Für einen Kohlenwasserstoff ist Cyclopentadien also eine recht starke Säure! Warum ist das so?
Im Cyclopentadienyl-Anion, das durch die Abgabe des Protons entsteht, ist das "obere" C-Atom nicht mehr sp3-hybridisiert, sondern sp2-hybridisiert, wie alle Carbo-Anionen. Die Lücke in den pz-Orbitalen wird also aufgefüllt, womit die Regel 2 und gleichzeitig Regel 5 erfüllt werden. Auch erhöht sich die Zahl der pi-Elektronen von 4 auf 6, womit dann auch Regel 4 erfüllt ist.
"It is a regular pentagonal, planar, cyclic ion; as well, it has 6 π-electrons (4n+2, where n=1), which fulfills Hückel's rule of aromaticity." [1]
Beispiel Anthracen
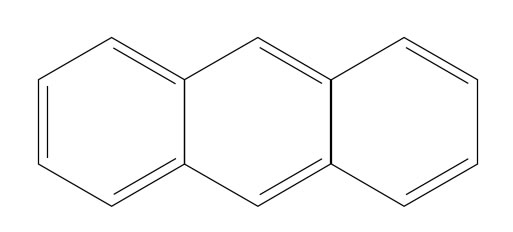
Das Anthracen-Molekül
Das Anthracen-Molekül erfüllt die Hückel-Regeln!
Das gesamt Molekül ist als ein großer Ring aus drei Abschnitten anzusehen (Regel 1 erfüllt), alle Ringatome sind sp2-hybridisiert, damit ist Regel 2 erfüllt. Regel 3 ist erfüllt, weil das gesamte Molekül planar ist. Mit n=3 gilt 4n+2 = 14, was genau der Zahl der pi-Elektronen entspricht, und die Regel 5 ist auch erfüllt, es gibt keine Lücke oder Unterbrechung des Ringes.
Im Chemie-Lexikon auf dieser Homepage finden Sie weitere Beispiele für Aromaten, die die Hückel-Regel erfüllen.
Quellen:
- engl. Wikipedia, Artikel "Cyclopentadienyl anion"
- Wikipedia, Artikel "Cyclopentadien"
- Römpp Chemie-Lexikon, 9. Auflage 1992