Entdeckung
Das Element Brom wurde 1826 von Antoine-Jérôme Balard entdeckt, als er Meeresalgen untersuchte. Bereits zwei Jahre vorher isolierte Justus Liebig Brom aus Salzsolen, merkte aber nicht, dass er ein neues Element entdeckt hatte.
Vorkommen
Das sehr reaktive Halogen kommt als freies Element so gut wie nicht vor, wenn man von Spuren von Br2 in der Erdatmosphäre einmal absieht. In gebundener Form findet es sich dagegen in vielen Salzen, vor allem in den Bromiden und Bromaten. Das wichtigste Bromid ist wohl das Kaliumbromid. Die Steinsalzlager enthalten neben NaCl vor allem KCl und MgCl2. Am Aufbau der Erdkruste ist Brom mit weniger als 0,001% beteiligt, Chlor kommt 250 mal häufiger in Salzlagern vor. Meerwasser enthält ca. 0,0065% Bromid, das Tote Meer allerdings hat einen Bromidgehalt von bis zu 1,5% (Lexikon der Chemie).
Darstellung
Im Labor wird Brom durch Reaktion von konz. Schwefelsäure und Braunstein mit Kaliumbromid gewonnen. Aus Schwefelsäure und Kaliumbromid entsteht zunächst Bromwasserstoff HBr (analog zur Herstellung von Chlorwasserstoff aus konz. Schwefelsäure und Natriumchlorid), und dieser reagiert dann mit dem Braunstein nach folgender Gleichung:
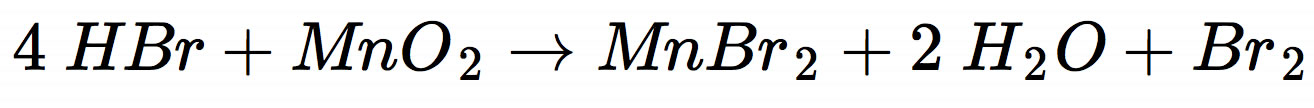
In der Industrie wird Brom durch Oxidation von Bromidlösungen mit Chlor hergestellt - eine typische Redoxreaktion, an der Nichtmetalle beteiligt sind und die auch im Chemieunterricht eine wichtige Rolle spielt, wenn in der Oberstufe die Redoxpotenziale der Halogene erklärt werden:
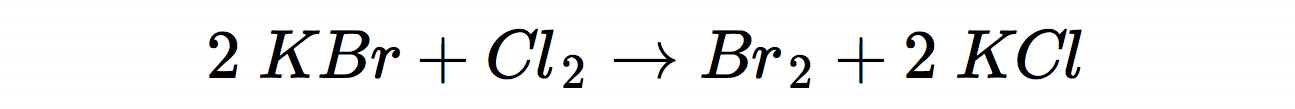
physikalische Eigenschaften
Brom ist bei Zimmertemperatur eine tiefbraune, beißend und erstickend riechende Flüssigkeit. Neben Quecksilber ist Brom überhaupt das einzige Element, das bei Raumtemperatur flüssig ist. Die Dichte von flüssigem Brom liegt bei 3,12 g/cm2 und ist damit für eine Flüssigkeit recht hoch. Festes Brom zeichnet sich durch einen leicht metallischen Glanz aus.
In Wasser ist Brom mäßig löslich (3,55 g Brom in 100 ml Wasser bei Zimmertemperatur), es bildet sich dann Bromwasser, das beim Experimentieren in Schulen oft als Ersatz für reines Brom verwendet wird. In organischen Lösemitteln ist Brom aufgrund seiner völlig unpolaren Struktur dagegen sehr gut löslich.
chemische Eigenschaften
Brom ist ähnlich wie Chlor extrem reaktiv, es reagiert mit den meisten Elementen und mit vielen Verbindungen, auch mit organischen Verbindungen.
Reaktion mit Metallen
Mit Metallen bildet Brom in meist exothermen Reaktionen Salze, nämlich die Bromid. Je edler das Metall ist, desto weniger exotherm verläuft die Reaktion. Die Umsetzung mit Alkalimetallen und Erdalkalimetallen findet bereits bei Zimmertemperatur statt, edlere Metalle wie Kupfer oder Silber muss man mehr oder weniger stark erhitzen, damit sie mit Chlor reagieren. Feuchtes (wasserhaltiges) Brom reagiert mit Metallen wesentlich heftiger als reines Brom. Tantal und Platin sind die einzigen Metalle, die selbst mit feuchtem Brom nicht reagieren (Wikipedia).
Reaktion mit Nichtmetallen
Mit Wasserstoff bildet Chlor die starke Säure Chlorwasserstoff HCl, deren wässrige Lösung als Salzsäure bekannt ist. Auch diese Reaktion läuft extrem exotherm ab (Chlor-Knallgas-Reaktion). Mit anderen Nichtmetallen reagiert Chlor kaum oder gar nicht.
Reaktion mit organischen Verbindungen
Mit Alkanen und Alkylverbindungen reagiert Brom in einer radikalischen Substitutionsreaktion zu Halogenalkanen. Mit Alkenen und Alkinen findet eine elektrophile Addition statt, und mit Aromaten ist eine elektrophile Substitution möglich, wenn ein geeigneter Katalysator vorhanden ist.
Verwendung
Brom wird vor allem in der organischen Chemie verwendet, um Substitutionen oder Additionen an Kohlenwasserstoffen oder anderen organischen Verbindungen durchzuführen. Diese Reaktionen spielen bei der Herstellung von Treibstoffzusätzen, Flammschutzmitteln, Pestiziden, Tränengas und so weiter eine wichtige Rolle.
In der letzten Zeit hat die Verbindung Hexabromcyclododecan Schlagzeilen gemacht, weil sie dem Kunststoff Styropor als Flammschutzmittel beigesetzt wird. Hexabromcyclododecan gilt jetzt als hochgiftig und schwer abbaubar, was die Preise für die Entsorgung von Styropor in die Höhe getrieben hat. Die Entsorgung von einer Tonne Styropor kostet jetzt teilweise über 9.000 Euro - und das alles wegen dem Brom in dem Flammschutzmittel.