Schritt 1: Nucleophile Addition eines Hydroxyd-Ions
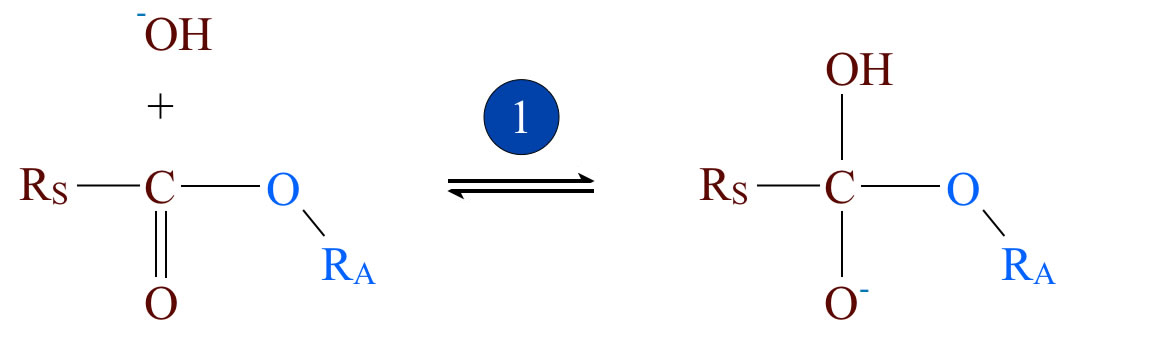
Der erste Schritt ist die Addition einer negativ geladenen Hydroxid-Gruppe an das C-Atom der Carbonylgruppe des Esters. Die C=O-Doppelbindung löst sich dabei auf, und am C-Atom befinden sich eine OH-Gruppe, der Alkylrest der Säure RS- , der Alkohol -O-RA und schließlich ein negativ geladenes Sauerstoff-Atom. Dieser Reaktionsschritt ist voll reversibel.
Schritt 2: Abspaltung des Alkohols
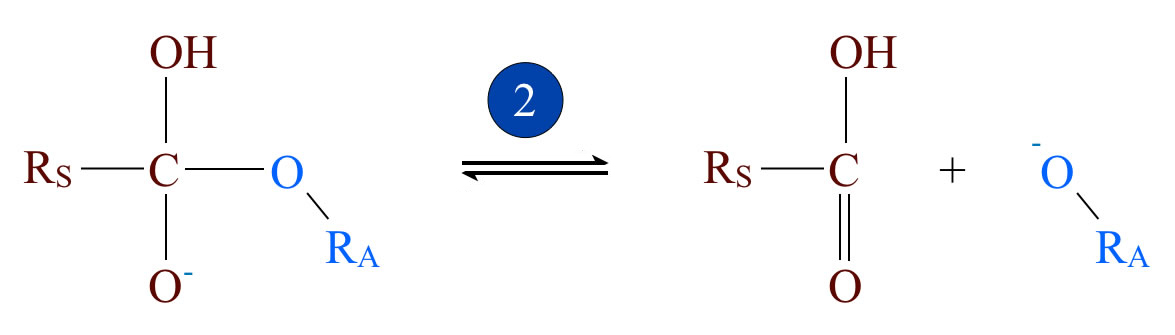
Im zweiten Schritt der Verseifung wird der Alkohol abgespalten, allerdings nicht als neutraler Alkohol, sondern als negativ geladenes Alkoholat-Ion RA-O-. Das zweite Produkt dieser Spaltung ist die Carbonsäure RS-COOH. Auch dieser Reaktionsschritt ist voll reversibel.
Schritt 3: Übertragung eines Protons
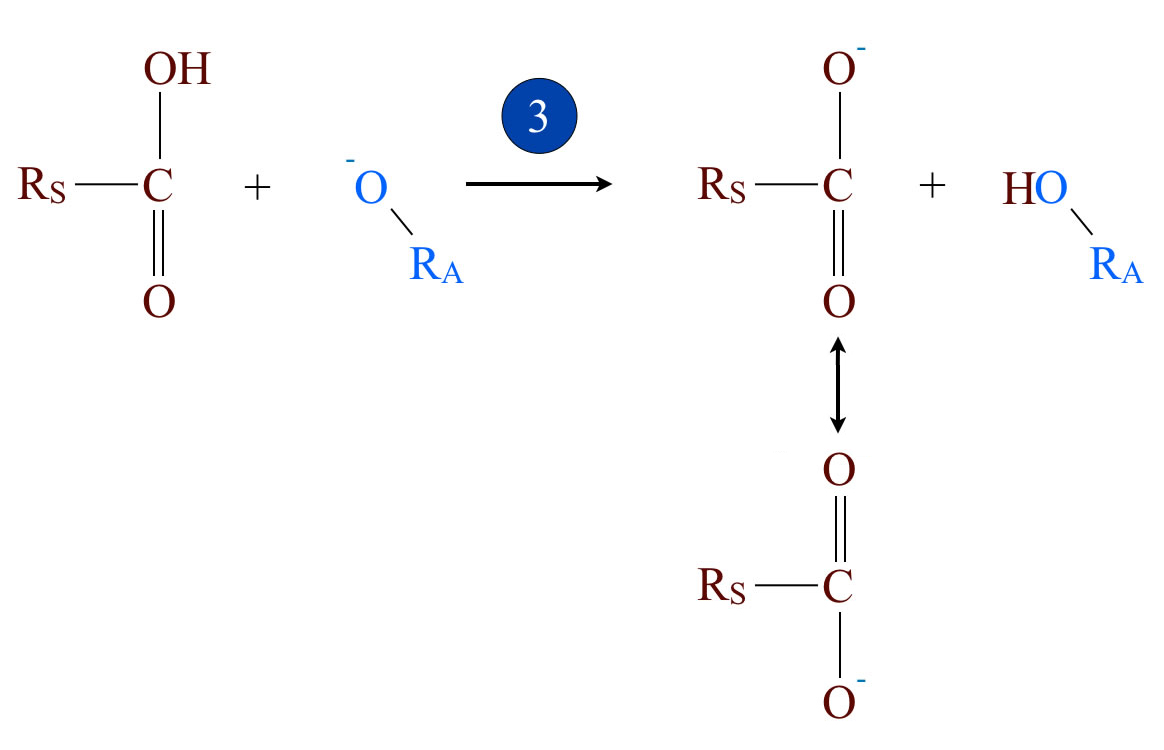
Der dritte Schritt ist die Reaktion des Carbonsäure-Moleküls RS-COOH mit dem Alkoholat-Ion. Das H-Atom der COOH-Gruppe wird nämlich von dem negativen O-Atom des Alkoholat-Ions aufgenommen. Es entsteht der elektrisch neutrale Alkohol RA-OH, und übrig bleibt der negativ geladene Säurerest RS-COO-. Das so entstandene Carboxylat-Ion ist derart stabil, dass es keine Rückreaktion eingeht. Dieser dritte Reaktionsschritt ist also nicht reversibel.
Die Ursache für die hohe Stabilität des Carboxylat-Ions ist seine Mesomeriestabilisierung, es gibt nämlich zwei Grenzstrukturen, wie man auf dem Bild sehen kann.
Da nun einer der drei Reaktionsschritte nicht reversibel verläuft, ist auch die Gesamtreaktion der Verseifung nicht reversibel und liefert daher eine sehr hohe Ausbeute an Reaktionsprodukt.
Wer sich für die Struktur und die Eigenschaften der COOH-Gruppe interessiert, sollte sich diese Seite in meinem Chemie-Lexikon anschauen.
Ist die Reaktion nicht basenkatalysiert?
Bei der Veresterung hatten wir gesehen, dass die Reaktion säurekatalysiert abläuft. Im ersten Reaktionsschritt spendet die zugesetzte Säure ein Proton, und im letzten Reaktionsschritt wird wieder ein Proton freigesetzt. In der Gesamtgleichung taucht dieses Proton nicht auf, daher kann man zu Recht von einer säurekatalysierten Reaktion sprechen.
Bei der auf dieser Seite beschriebenen Verseifung wird im ersten Schritt ein Hydroxid-Ion eingesetzt. Daher liegt der Gedanke nahe, hier von einer basenkatalysierten Reaktion zu sprechen.
Allerdings wird im letzten Schritt der Reaktion kein Hydroxid-Ion wieder freigesetzt. Das Alkoholat-Anion holt sich das fehlende Proton von der entstandenen Carbonsäure. Daher kann man hier nicht von einer basenkatalysierten Reaktion sprechen. Stattdessen hat sich in der Fachliteratur der Begriff "basenvermittelte Reaktion" eingebürgert, denn die Base OH- spielt ja eine entscheidende Rolle im ersten Reaktionsschritt, ohne Vorhandensein der OH--Ionen würde die Reaktion nicht ablaufen.
Man könnte nun natürlich einwenden: Was ist denn, wenn sich das Alkoholat-Ion das fehlende Proton von einem Wasser-Molekül holt? Dann würde ja ein Hydroxid-Ion entstehen, und dann müsste man eigentlich wieder von einer basenkatalysierten Reaktion sprechen.