3.1 Rekapitulation Schulwissen
In den Schulbüchern der gymnasialen Oberstufe wird die Stoffklasse der Carbonsäuren meistens sehr ausführlich behandelt, vor allem im Zusammenhang mit der Säure-Base-Chemie und dem chemischen Gleichgewicht. Auf die physikalischen Eigenschaften der Carbonsäuren wird auch manchmal eingegangen, vor allem auf die hohen Siedepunkte und die große Wasserlöslichkeit der kurzkettigen Carbonsäuren.
Beide Eigenschaften werden mit der Fähigkeit der COOH-Gruppe zur Bildung von H-Brücken erklärt.
3.2 Studienvorbereitung
Siedepunkte
Vergleichen wir die Siedepunkt einiger Carbonsäuren mit denen entsprechender Aldehyde und Alkohole
- Ethanol: 78,3 ºC
- Ethanal: 20 ºC
- Ethansäure: 118 ºC
- Propan-1-ol: 97 ºC
- Propanal: 49 ºC
- Propansäure: 141 ºC
Diese hohen Siedepunkte sind nicht nur den beiden polaren C=O- und O-H-Bindungen geschuldet, sondern vor allem der Fähigkeit der COOH-Gruppe, H-Brücken zwischen den Molekülen zu bilden. Die COOH-Gruppe verfügt über einen H-Brücken-Donator (das H-Atom der OH-Gruppe) und über zwei H-Brücken-Akzeptoren (beide O-Atome). Daher können sich - ähnlich wie bei H2O-Molekülen - im flüssigen Zustand sogar Netzwerke aus Carbonsäure-Molekülen bilden.
Wasserlöslichkeit
Wegen der Fähigkeit, sowohl als H-Brücken-Akzeptor wie auch als H-Brücken-Donator zu fungieren, ist es kein Wunder, wenn Carbonsäuren in hohem Maße wasserlöslich sind.
- Methansäure: unbegrenzt
- Ethansäure: unbegrenzt
- Propansäure: unbegrenzt
- Butansäure: unbegrenzt
- Pentansäure: 25 g/l
- Hexansäure: 8,9 g/l
- Heptansäure: 2,4 g/l
- Octansäure: 0,68 g/l
- Zitronensäure: unbegrenzt
Zur Buttersäure (Butansäure) liest man unterschiedliche Angaben zur Wasserlöslichkeit. Der Römpp schreibt, dass Buttersäure unbegrenzt mit Wasser mischbar ist, in der Wikipedia findet man einen Wert von 370 g/l, und im Sicherheitsdatenblatt der Firma Roth steht sogar etwas von nur 10 g/l Wasserlöslichkeit.
Je größer die Alkylgruppe der Carbonsäure ist, desto geringer wird der Einfluss der COOH-Gruppe, aber der Pentansäure sinkt daher die Wasserlöslichkeit deutlich.
Die Zitronensäure C6H8O7 ist wegen ihrer drei COOH-Gruppen wieder unbegrenzt mit Wasser mischbar. Diese Verbindung hat zwar sechs C-Atome wie die Hexansäure, aber drei COOH-Gruppen.
Dimerbildung
Flüssige Carbonsäuren liegen oft als Dimere vor, die COOH-Gruppen benachbarter Moleküle verbinden sich dabei über zwei H-Brücken:
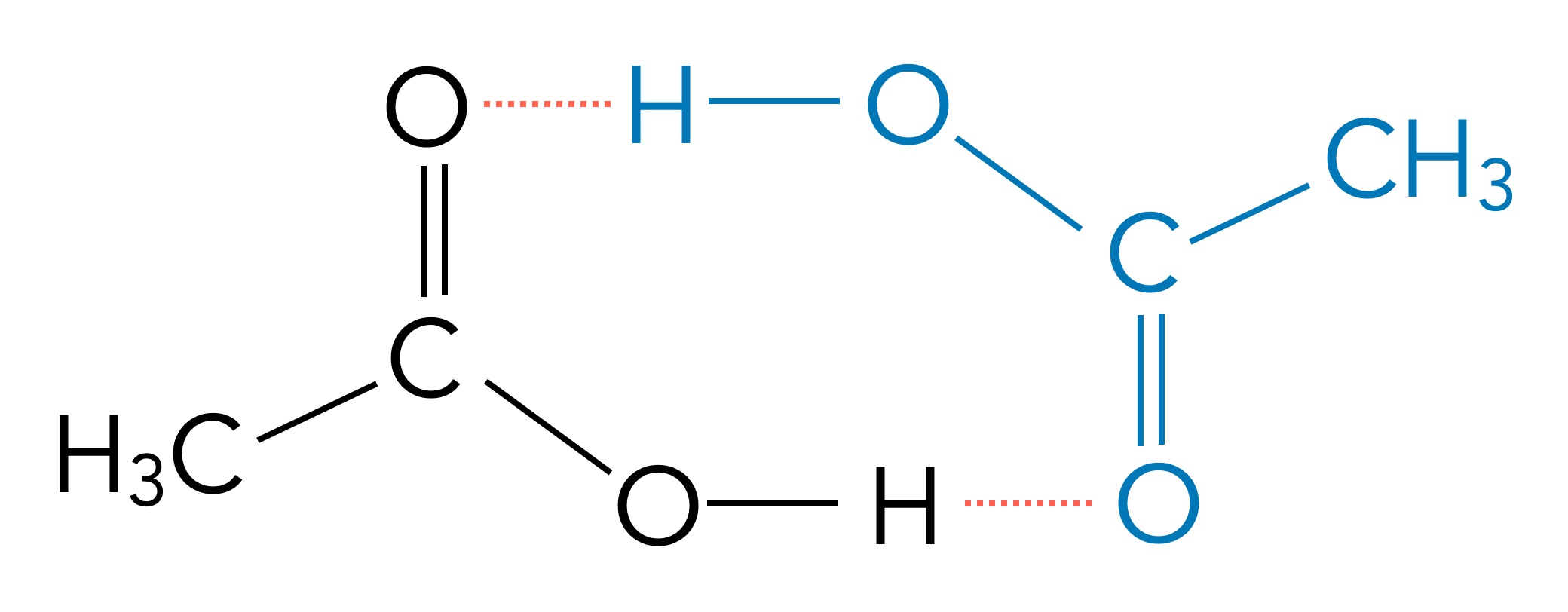
Dimerbildung bei der Essigsäure
Autor: Ulrich Helmich 05/2024, Lizenz: Public domain
Die Dimerbildung könnte eine weitere Ursache für die hohen Siedepunkte der Carbonsäuren sein: "For boiling to occur, either the dimer bonds must be broken or the entire dimer arrangement must be vaporized, increasing the enthalpy of vaporization requirements significantly." [3].
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- engl. Wikipedia, Artikel "Carboxylic acid"
Seitenanfang -
Weiter mit den Säure-Base-Eigenschaften der Carbonsäuren...